|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Осмос |
 |
Диффузия вещества через полупроницаемую перегородку, разделяющую два раствора различной концентрации.
Описание
Осмос (от греческого osmos – толчок, давление) – самопроизвольный переход вещества через полупроницаемую перегородку (мембрану), разделяющую два раствора различной концентрации или раствор и чистый растворитель. Осмос приближает систему к равновесию путём выравнивания концентраций по обе стороны перегородки. Он обусловлен понижением химического потенциала в присутствии растворённого вещества. Стремясь к выравниванию химического потенциалов всех своих частей, система переходит в состояние с более низким уровнем свободной энергии при осмотическом переносе вещества.
Наиболее важный случай осмоса – переход молекул чистого растворителя в раствор через полупроницаемую перегородку, не пропускающую молекулы растворённого вещества. В этом случае происходит переход молекул из чистого растворителя в раствор, концентрация которого при этом понижается. В общем случае двух растворов A и B разной концентрации (концентрация раствора A больше, чем B) возникает поток вещества от A к B. Этот поток можно предотвратить, если повысить давление в растворе B, причём разность давлений π по обе стороны перегородки при этих условиях называется осмотическим давлением, а достигнутое термодинамическое равновесие – осмотическим равновесием. Значение π зависит от состава раствора и температуры и для разбавленных и идеальных растворов не зависит от растворённых веществ, а определяется лишь числом «кинетических элементов» – атомов, ионов, молекул – в единице объёма раствора.
Если A – чистый растворитель, а B – идеальный раствор неэлектролита (недиссоциирующего вещества), то
πV = –RTln(1 – x),
где V – молярный объём растворителя, x – мольная доля растворённого вещества. Для разбавленных растворов (x << 1) неэлектролитов
π = cRT,
где c – молярность раствора, из этого уравнения (уравнения состояния Вант-Гоффа), совпадающего по форме с уравнением Бойля – Мариотта для идеального газа, следует, что я численно равно парциальному давлению, которое оказывало бы растворённое вещество в состоянии идеального газа при той же температуре, занимая объём, равный объёму раствора. Для разбавленных растворов электролитов
π = icRT,
где i = 1 + α(v – l), α – степень диссоциации, v – число ионов, на которое распадается молекула электролита; коэффициент i называется коэффициентом Вант-Гоффа.
Растворы с одинаковым i называется изотоническими (изоосмотическими). Так, кровезаменители и физиологические растворы должны быть изотоничны по отношению к жидкостям организма. Если раствор имеет относительно другого раствора более высокое осмотическое давление, то он называется гипертоническим, при обратном соотношении – гипотоническим.
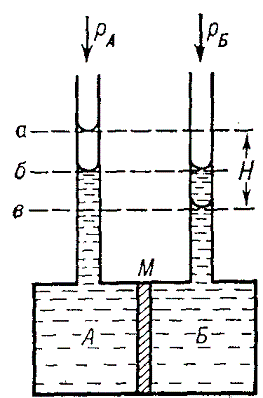
Осмотическое давление измеряют с помощью осмометров. Различают статические и динамические методы измерений. Первый основан на измерении избыточного гидростатического давления Δp по высоте столба жидкости H в трубке осмометра (рисунок 1) после установления осмотического равновесия и при равенстве внешнего давлений в камерах A и B. Второй метод основан на измерении скорости всасывания и выдавливания растворителя при различных значениях Δp с последующей интерполяцией полученных данных. В качестве мембраны обычно применяют плёнки из целлофана, полимеров, пористые керамических и стеклянные перегородки.
Схема осмометра. А – камера с раствором, Б – камера с растворителем, М – мембрана; уровни жидкости в трубках при осмотическом равновесии: а и в – в условиях равенства внешних давлений в камерах А и Б (столб жидкости H уравновешивается π); б – в условиях, когда Δp – π.
Рис.1
Ключевые слова
Разделы наук
Применение эффекта
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворенном состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию. Примером являются эвкалипт, бамбук (трава). Также клетки растений используют осмос для увеличения объёма вакуоли, чтобы она распирала стенки клетки. Засчёт этого повышается упругость растения в целом. Увеличевая или уменьшая вакуоли клеток, растение может двигаться (например, усики гороха). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для постоянного процента растворённых в ней веществ.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом "обратного" осмоса жидкостей.
Реализации эффекта
Аномальный осмос - движение растворителя через полупроницаемую мембрану, не соответствующее размеру или направлению перепада осмотического давления (осмотического градиента). При этом из раствора с большим осмотическим давлением растворитель перемещается в раствор с меньшим осмотическим давлением. Аномальный осмос объясняют электроосмотическим переносом растворителя через капилляры, пронизывающие мембрану. Аномальный осмос наблюдается при транспорте воды в растительных и животных тканях.
Обратный осмос — технология очистки воды от примесей. Основана на процессе диффузии, который непрерывно происходит в клетках живых организмов и называется осмосом (молекулы воды поступают внутрь клетки,окруженной полупроницаемой мембраной через поры мембраны из раствора с меньшей концентрацией солей в раствор с большей концентрацией). Если со стороны раствора с большей концентрацией солей создать определенное давление, то происходит обратный процесс (обратный осмос): молекулы воды начинают проникать через поры мембраны из раствора с большей концентрацией солей в раствор с меньшей концентрацией.
Обратноосмотический процесс в системах очистки воды также основан на прохождении молекул воды через полупроницаемую синтетическую мембрану, при котором абсолютное большинство загрязнений удаляется. При этом загрязнения, находящиеся в концентрированном растворе солей (концентрате), во избежание засорения мембраны сбрасывают в дренаж. Такая высокая степень очистки связана с очень маленьким диаметром пор мембраны, которые в 200 раз меньше размеров вирусов и в 4000 раз меньше размера бактерий. Системы очистки воды методом обратного осмоса, благодаря низким эксплуатационным затратам, пользуются большой популярностью среди потребителей.
Этот процесс требует создания давления со стороны концентрата, обычно 2-17 атм. для питьевой и солоноватой воды, и 40-70 атм. для морской воды, которая имеет естественное осмотическое давление порядка 24 атм., которое требуется преодолеть.
Процесс обратного осмоса широко используется для опреснения морской воды и очищения питьевой воды для различных целей с начала 1970-х годов.
Осморегуляция - совокупность процессов, происходящих в живом организме (одноклеточном или многоклеточном), направленных на поддержание постоянного осмотрического давления. Осморегуляция присуща всем пресноводным и наземным животным, среди морских организмов осморегуляцией обладают все позвоночные (кроме миксин), некоторые ракообразные.
У высших организмов при изменении осмотического давления крови или межклеточной жидкости осморецепторы генерируют импульсы, которые передаются в нервные центры. При этом осуществляется управление потреблением воды и солей (и их выделением) осморегулирующими органами — нефридиями, почками, солевыми железами и т.д.
Механизм осморегуляции называют гиперосмотическим, когда осмотическое давление в жидкости внутренней среды больше, чем во внешней среде, и гипоосмотическим, если внутреннее давление меньше внешнего. При гиперосмотическом механизме избыток воды выводится у животных в основном почками, а у растений - с помощью устьиц. При гипоосмотическом механизме недостаток воды (при пассивной потере через покровы тела) компенсируется в результате потребления богатой солями воды, а избыток солей выводится преимущественно через солевые железы. Все пресноводные животные и морские хрящевые рыбы имеют гиперосмотическую регуляцию. Гипоосмотический механизм используется морскими костистыми рыбами, морскими пресмыкающимися и некоторыми другими.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. М.: Химия. 1978.
2. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. М.: Химия. 1978.


![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. М.: Химия. 1978.
2. Дытнерский Ю.И. Обратный осмос и ультрафильтрация. М.: Химия. 1978.