|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Принцип Ле-Шателье-Брауна |
 |
Возбуждение в системе, выеденной из состояния термодинамического равновесия, процессов, стремящихся ослабить результат внешнего воздействия.
Описание
Общее условие устойчивости равновесия изолированных систем может быть сформулировано на основе закона возрастания энтропии. Из этого закона следует, что возрастание энтропии изолированной системы происходит до тех пор, пока в ней не затухают все необратимые процессы. В этом случае энтропия достигает максимального значения. Следовательно, условие устойчивости состояния термодинамической системы можно сформулировать следующим образом: Если энтропия адиабатически изолированной термодинамической системы принимает максимальное значение, то ее состояние термодинамически устойчиво.
Данное условие означает, что при устойчивом термодинамическом равновесии энтропия S адиабатически изолированной системы имеет экстремум: S = S∞, где S∞ - энтропия системы в состоянии термодинамического равновесия. Следовательно, в состоянии устойчивого равновесия первая вариация энтропии δS изолированной термодинамической системы равна нулю δS = 0, а вторая ее вариация δ2S - меньше нуля: δ2S < 0. В данном случае под вариацией энтропии понимается ее бесконечно малое изменение при бесконечно малом изменении параметров состояния, которые приводят к переводу системы в неравновесное состояние. Условие равенства нулю первой вариации энтропии δS = 0 дает необходимое условие равновесия изолированной системы, а неравенство δ2S < 0 - достаточное условие устойчивости равновесного состояния.
На термодинамическую систему, находящуюся в состоянии устойчивого равновесия, могут воздействовать внешние факторы, выводящие ее из этого состояния. Реакцию системы на эти воздействия можно качественно определить на основе принципа Ле-Шателье - Брауна, предложенного в 1884 году французским химиком Анри Луи Ле-Шателье (1850 - 1936) и обоснованного в 1887 году немецким физиком Карлом Фердинандом Брауном (1850 - 1918):
Внешние воздействия, выводящие термодинамическую систему из состояния устойчивого равновесия, вызывают в ней протекание процессов, которые уменьшают влияние этих внешних возмущений.
Например, повышение температуры химической реакции благоприятствует накоплению тех веществ, которые образуются в данной реакции с поглощением тепла, а понижение температуры действует в противоположном направлении. Вещества, растворимость которых при повышении давления увеличивается (при постоянной, температуре), растворяются с уменьшением объёма, а при обратной зависимости от давления – с увеличением объёма.
Принцип смещения равновесия при изменении температуры установил Я. Вант-Гофф в 1884. Общий принцип, отражающий влияние различных факторов на положение термодинамическое равновесия, сформулировали А. Ле Шателье в 1884 и К. Браун в 1887. Они исходили из аналогии с правилом Ленца в электродинамике и рассматривали различные примеры термодинамического равновесий, которые можно представить в форме, похожей на правило Ленца.
Удобство Ле Шателье-Брауна принципа состоит в том, что он позволяет определить направление смещения термодинамического равновесия без детального анализа условий равновесия (иногда очень сложных). Ле Шателье-Брауна принцип строго выводится из общих условий термодинамич. равновесия, установленных Дж. Гиббсом (J. Gibbs).
Чтобы легче понять принцип Ле Шателье-Брауна, рассмотрим простую химическую реакцию. Два вещества (реактивы) взаимодействуют друг с другом, в результате взаимодействия образуется третье вещество (продукт), которое стремится к расщеплению на исходные вещества. Это можно изобразить в виде следующего уравнения:
A + B ↔ C
Двойная стрелка обозначает обратимую реакцию. При протекании прямой реакции слева направо происходит образование вещества C из веществ A и B. В случае обратной реакции (справа налево) вещество C расщепляется на вещества A и B. Когда эта система находится в химическом равновесии, скорости прямой и обратной реакций одинаковы – в одной точке данной системы образуется молекула вещества C, а где-то в другом месте другая молекула вещества С распадается.
Если в систему добавить избыток вещества A, равновесие временно нарушится, так как вырастет скорость образования вещества C. Но чем быстрее будет расти концентрация вещества C, тем быстрее оно будет расщепляться – пока снова не будет достигнуто равновесие между прямой и обратной реакциями. Тогда скорость образования вещества C из веществ A и B сравняется со скоростью расщепления вещества С на вещества A и B.
Действие принципа Ле Шателье-Брауна можно проследить на примере изменения химического состава дождя или растворения шипучей антацидной (снижающей кислотность желудочного сока) таблетки в воде. В обоих случаях в химической реакции участвуют углекислый газ (CO2), вода(H2O) и угольная кислота (H2CO3):
CO2 + H2O ↔ H2CO3
Когда дождевая капля попадает в воздух, она поглощает углекислый газ, и концентрация в левой части реакции возрастает. Для поддержания равновесия образуется большее количество угольной кислоты. В результате дождь становится кислотным. Добавление углекислого газа смещает равновесие реакции вправо. Противоположная реакция происходит при опускании в воду таблетки антацида (вещества, нейтрализующего кислоту). Бикарбонат натрия (антацид) вступает в реакцию с водой, и образуется угольная кислота, что приводит к увеличению концентрации вещества в правой части реакции. Чтобы восстановилось равновесие, угольная кислота разлагается на воду и углекислый газ, который мы и наблюдаем в виде пузырьков.
Ключевые слова
Разделы наук
Применение эффекта
Сформулированный принцип позволяет предсказать направление протекания процессов в термодинамической системе, которая выводится из состояния устойчивого равновесия внешними воздействиями. Рассмотрим наглядный пример применения принципа Ле-Шателье-Брауна. Пусть имеется смесь льда и воды, находящаяся в состоянии устойчивого равновесия. Если этой смеси сообщить некоторое количество теплоты, то лед начнет таять, что будет препятствовать повышению температуры смеси. То есть, протекающий в системе процесс таяния льда будет ослаблять изменения, вызываемые подводом теплоты.
Примером использования в техническом устройстве процессов, следующих из принципа Ле-Шателье - Брауна, является поглощение газа в адсорбционных вакуумных насосах. Химическая адсорбция газа, как правило, происходит с выделением теплоты. Соответственно при охлаждении вещества (адсорбента), наблюдается резкое увеличение поглощения им газа, что позволяет уменьшить давление этого газа в вакуумируемом сосуде. При нагреве адсорбента газ из него выделяется, и система возвращается в исходное состояние.
Реализации эффекта
Рассмотрим следующую задачу: один моль идеального газа находится в эластичной оболочке, с внешней стороны которой действует постоянное давление. Нужно показать, что при подводе к этому газу некоторого количества теплоты ΔQ произойдет его расширение, приводящее, в соответствии с принципом Ле-Шателье - Брауна, к уменьшению изменения его температуры ΔT по сравнению с изменением температуры ΔT0, которое имело бы место при неизменном объеме газа: ΔT < ΔT0. Рассмотрим случай, когда в этой оболочке находится фотонный газ.
Для одного моля идеального газа в случае изобарического процесса изменение температуры может быть вычислено по формуле
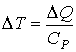
,
а для изохорического - соответственно определяется выражением
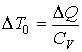
.
Из этих формул имеем:
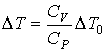
.
Так как CP>CV, то ΔT < ΔT0. Из этого следует, что в рассматриваемой термодинамической системе при внешнем воздействии (подводе теплоты) возникает процесс (расширение газа), приводящий к уменьшению влияния внешнего возмущения: изменение температуры газа меньше, чем, если бы расширение не возникало.
Если в оболочке находится фотонный газ, уравнение состояния которого имеет вид: P = αT4, то при подводе теплоты в изобарическом процессе при ΔP = 0, изменение температуры не происходит: ΔT = 0. А для изохорического процесса, учитывая выражение для внутренней энергии фотонного газа: U = 3αT4V, можно записать
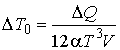
,
где изменение температуры ΔT0 считается малым, по сравнению с температурой газа T: ΔT0 << T.
Таким образом, происходящие в системе процессы могут не только уменьшить влияние внешнего воздействия, но и скомпенсировать его полностью. Из рассмотренного примера фотонного газа в эластичной оболочке следует, что для такой термодинамической системы подвод теплоты не приводит к увеличению её температуры.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Сторонкин А. В., Термодинамика гетерогенных систем. Л., 1967.
2. Сторонкин А. В., Термодинамика гетерогенных систем. Л., 1967.


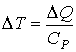 ,
,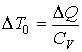 .
.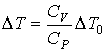 .
.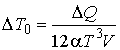 ,
,![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Сторонкин А. В., Термодинамика гетерогенных систем. Л., 1967.
2. Сторонкин А. В., Термодинамика гетерогенных систем. Л., 1967.