|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Рауля закон |
 |
Рауля закон
Описание
Закон Рауля: относительное понижение парциального давления пара растворителя над разбавленным бинарным раствором неэлектролита равно молярной доле растворенного вещества xB:
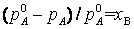
,
где pA – парциальное давление растворителя, poA – давление насыщенного пара чистого растворителя. Соответственно для молярной доли растворителя xA можно записать:
Если пар над раствором нельзя считать идеальным газом, давления poA и pA заменяют на фугитивности fА и foА :
Растворы, для которых Рауля закон выполняется во всем интервале концентраций для обоих компонентов, называют идеальными (совершенными). Для идеального раствора термодинамическая активность компонента aA равна его молярной доле xA (aA = xA), а химический потенциал компонента, по определению, равен:
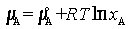
,
где Т – абсолютная температура, R – газовая постоянная, μoA – стандартный химический потенциал. Парциальное давление растворенного вещества при постоянной температуре пропорционально его молярной доле, зависимость осмотического давления раствора от концентрации растворенного вещества выражается законом Вант-Гоффа.
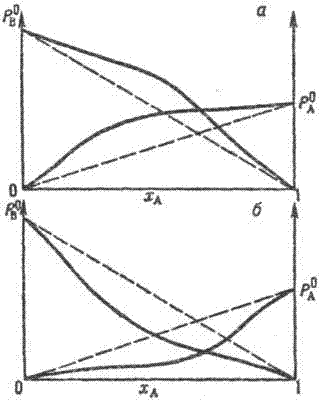
Положительные (а) и отрицательные (б) отклонения раствора от идеальности. На оси абсцисс отложена молярная доля растворителя (компонент А), по оси ординат-парциальное давление растворенного вещества (компонент В). Пунктиром показаны соответствующие зависимости для идеального раствора
Рис.1
Для множества бинарных систем-жидких и твердых растворов, расплавов, многокомпонентных смесей – Рауля закон выполняется с достаточной точностью и служит хорошим приближением для определения парциальных давлений при молярной доле растворенного вещества до 0,1–0,5. Если парциальные давления компонентов выше значений, предсказываемых Рауля законом, говорят о положительных отклонениях от идеальности, если ниже – об отрицательных отклонениях. Для смесей органического вещества типа С6Н6–(СН3)2СО, (С2Н5)2О-СНСl3 отклонение от идеальности не превышает 100% (рис. 1). При сильном взаимодействии компонентов, например в случае расплава KF-AlF3, парциальные давления компонентов может быть ниже рассчитанных в соответствии с Рауля законом на 5–10 порядков.
Ключевые слова
Разделы наук
Применение эффекта
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Я.Г. Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
ΔTfr = iKm; ΔTb = iEm
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С.А. Аррениусом теории электролитической диссоциации.
Реализации эффекта
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
* Парциальное давление насыщенного пара компонента раствора прямо пропорционально его моляльной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
* Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его моляльной доле в растворе.
Растворы, для которых выполняется закон Рауля, называюся идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °С.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
* Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (т.е. давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
* Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Стромберг А.Г., Семченко Д.П. Физическая химия — М.: Высшая школа, 1999. 527 с.
2. Стромберг А.Г., Семченко Д.П. Физическая химия — М.: Высшая школа, 1999. 527 с.
 3. Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.
3. Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.


 Физико-химические явления
Физико-химические явления Жидкости
Жидкости Реальные газы
Реальные газы Явления переноса
Явления переноса Термодинамика
Термодинамика Общие вопросы газо- и гидродинамики
Общие вопросы газо- и гидродинамики![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Стромберг А.Г., Семченко Д.П. Физическая химия — М.: Высшая школа, 1999. 527 с.
2. Стромберг А.Г., Семченко Д.П. Физическая химия — М.: Высшая школа, 1999. 527 с.
![]() 3. Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.
3. Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.