|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Диссоциация молекул. |
 |
Диссоциация молекул.
Описание
Диссоциация молекул (от латинского dissociatio – разделение, разъединение) – распад молекулы на две или несколько частей – свободные радикалы, ионы или другие молекулы.
иссоциация молекул возникает под воздействием тепла, света, электрического поля и так далее, в соответствии с этим различают тепловую (термическую), фотохимическую диссоциацию молекул и так далее При тепловой диссоциации молекул молекулы распадаются либо на свободные радикалы, имеющие неспаренные электроны (например, CH3–OH → CH3– +OH+), либо на разные молекулы или атомы (например, H2O → Н2 + O). Продуктами фотохимическая диссоциация молекул являются атомы или свободные радикалы в основном или возбуждённом электронных состояниях (например, CH3I + hv → CH3 + I; v – частота внешнего излучения). Диссоциация молекул в полярных растворителях называется электролитической диссоциацией.
Диссоциация молекул чаще всего – процесс обратимый, характеризуемый константой равновесия диссоциации KД. Отношение числа диссоциировавших молекул к общему числу молекул называют степенью диссоциации. Энергия, требуемая для диссоциации одной молекулы в свободном состоянии (в идеальном газе) при OH, называется энергией диссоциации. Энергия диссоциации характеризует прочность химической связи и измеряется методом электронного удара, калориметрически, из исследования термодинамического равновесии, а также с помощью спектроскопических и кинетических методов.
Энергия диссоциации молекул определяется видом потенциальной поверхности молекулы. В случае двухатомной молекулы зависимость потенциальной энергии U от межъядерного расстояния r для осного электронного состояния молекулы обычно удовлетворительно описывается кривой Морзе:
U(r) = D(1–exp[–a(r–r0)])2,
где r0 – равновесное межъядерное расстояние, D – энергия диссоциации, a – параметр, характеризующий крутизну потенциальной ямы.
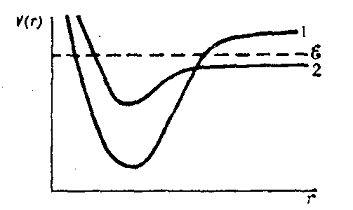
В случае пересечения кривых потенциальной энергии двух электронных уровней (обычно основного и возбуждённого) наблюдается предиссоциация (рисунок 1).
Условия возникновения предиссоциации. Кривые потенциальной энергии, соответствующие электронным состояниям 1 и 2, пересекаются. В состоянии 2 энергия попадает в область непрерывного спектра. ε – энергия некоторого колебательного уровня устойчивости молекулы в электронном состоянии 1. При переходе 1 → 2 происходит передиссоциация молекул
Рис.1
Если ε – некоторый колебательный уровень энергии устойчивой молекулы в состоянии 1 расположен так, как показано на рисункек, то при переходе из состояния 1 в состояние 2 произойдёт самопроизвольный распад молекулы. В результате предиссоциации основной уровень энергии, соответствующий кривой 1, обладает конечной продолжительностью жизни и, следовательно, «размывается», то есть уширяется.
Ключевые слова
Разделы наук
Применение эффекта
Из различных процессов термической диссоциации наибольшее практическое значение имеют разложение H2O, CO2, дегидрирование некоторых углеводородов (гомогенные реакции), диссоциация карбонатов, сульфидов (гетерогенные реакции). Их протекание связано со многими теплотехническими, химическими и металлургическими процессами, в частности с обжигом известняка, производством цементов и доменным процессом.
Одним из наиболее звестных явлений диссоциации является явление электролиза. Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — ионы кислотных остатков и гидроксильной группы — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия , хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Реализации эффекта
Термическая диссоциация - химическая реакция обратимого разложения вещества, вызываемая повышением температуры. При термической диссоциации из одного вещества образуется несколько (2Н2О ↔ 2Н2 + О2, CaCO3 ↔ CaO + СО2) или одно более простое (N2O4 ↔ 2NO2, Cl2 ↔ 2Cl). Равновесие термической диссоциации устанавливается по закону действующих масс. Оно может быть охарактеризовано или константой равновесия, или степенью диссоциации (отношением числа распавшихся молекул к общему числу молекул). В большинстве случаев термическая диссоциация сопровождается поглощением теплоты (приращение энтальпии ΔН > 0); поэтому в соответствии с принципом Ле Шателье - Брауна нагревание усиливает её, степень смещения термической диссоциации с температурой определяется абсолютным значением ΔН. Давление препятствует термической диссоциации тем сильнее, чем большим изменением (возрастанием) числа молей (Δv) газообразных веществ сопровождается процесс; при Δv = 0 степень диссоциации от давления не зависит. Если твёрдые вещества не образуют твёрдых растворов и не находятся в высокодисперсном состоянии, то давление термической диссоциации однозначно определяется температурой. Для осуществления термической диссоциации твёрдых веществ (окислов, кристаллогидратов и прочее) важно знать температуру, при которой давление диссоциации становится равным внешнему (в частности, атмосферному) давлению. Так как выделяющийся газ может преодолеть давление окружающей среды, то по достижении этой температуры процесс разложения сразу усиливается.
Большинство фотохимических процессов начинается с того, что вещество поглощает свет. Это приводит к переходу электронов его атомов или молекул на более высокий энергетический уровень – иначе говоря, к переходу их в возбужденное состояние. Такие атомы и молекулы ведут себя по-другому, чем когда они находятся в основном состоянии, и процессы, в которых они могут принимать участие, отличаются от обычных «тепловых» химических реакций. Согласно закону Планка, энергия фотона (кванта) излучения e связана с длиной волны λ соотношением E = ћc/λ, где ћ – постоянная Планка, с – скорость света. При поглощении кванта видимого света энергия возбужденной молекулы становится сравнимой с энергией химических связей, поэтому молекула может претерпеть химическое превращение – либо сама по себе, либо в результате взаимодействия с другой молекулой.
Анализ химических превращений, сопровождающих электронное возбуждение, приводит к двум основным законам фотохимии. Первый из них, сформулированный Т.Гротгусом и Дж.Дрейпером, состоит в том, что фотохимическую реакцию может инициировать только поглощенный свет. Второй закон, закон фотоэквивалентности Штарка – Эйнштейна, утверждает, что каждый поглощенный фотон возбуждает одну и только одну молекулу. (Появление мощных лазеров потребовало некоторой корректировки закона, поскольку второй фотон может столкнуться с молекулой, еще находящейся в возбужденном состоянии, и тогда произойдет двухфотонное возбуждение.) Экспериментальное подтверждение закона фотохимической эквивалентности дало А.Эйнштейну еще одно, уже химическое свидетельство правильности квантовой теории, которую он вместе с М.Планком и другими учеными сформулировал исходя из рассмотрения физических свойств молекул, поглотивших квант света.
Если молекула приобретает достаточно большое количество энергии, то может произойти разрыв какой-либо химической связи с образованием двух молекулярных осколков. Очень часто эти осколки являются химически активными атомами или свободными радикалами. Типичным примером такого процесса может служить разложение воды Н2О с образованием атома водорода Н и гидроксильного радикала ОН. Для этого нужен свет с длиной волны менее 242 нм. Фотодиссоциацию вещества часто называют фотолизом.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Глазов В.М. Основы физической химии - М.: Высшая школа.- 1961.
2. Глазов В.М. Основы физической химии - М.: Высшая школа.- 1961.


 Физико-химические явления
Физико-химические явления Жидкости
Жидкости Твердые тела
Твердые тела Реальные газы
Реальные газы Явления переноса
Явления переноса Термодинамика
Термодинамика Квантовая механика
Квантовая механика![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Глазов В.М. Основы физической химии - М.: Высшая школа.- 1961.
2. Глазов В.М. Основы физической химии - М.: Высшая школа.- 1961.