|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Реакция Белоусова-Жаботинского |
 |
Реакция Белоусова-Жаботинского
Описание
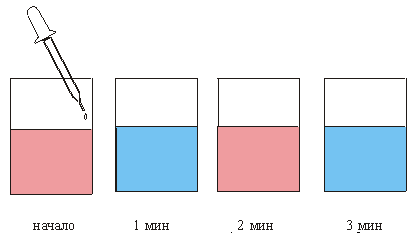
Вдали от равновесия возникают диссипативные пространственные и временные структуры, т. е. образуется неравновесный порядок. Иногда такой порядок состоит в появлении колебаний и волн, например, в химических диссипативных системах. Особенно ярко этот эффект проявился в так называемой реакции Белоусова- Жаботинского (БЖ): в стакан налита розовая жидкость, в которую из пипетки подаются капли бесцветной жидкости и раствор в стакане через 1 мин становится голубым, еще через минуту жидкость сама становится снова розовой и т. д. (рис. 1). Возникают как бы химические часы.
Схема реализации химических часов (реакция Белоусова-Жаботинского).
Рис.1
Это явление было открыто в 1951 г. химиком- экспериментатором Б. П. Белоусовым. Позднее, в 1959 г. А. М. Жаботинский детально изучил эту реакцию и дал качественное ее объяснение. Математическое моделирование подобных процессов в 1970 г. провел в Англии Тьюринг. За совокупность исследований реакций рассматриваемого типа Б. П. Белоусов и А. М. Жаботинский были удостоены в 1980 г. Ленинской премии. Такова краткая история, связанная с всемирно известной реакцией БЖ, а теперь обратимся к химическому механизму этого явления.
Реакция Белоусова — Жаботинского — химическая реакция окисления легкобромирующихся органических соединений броматом, катализируемая ионами металла. Под этим названием объединяется целый класс родственных химических систем, близких по механизму, но различающихся используемыми катализаторами (Ce3+, Mn2+ и комплексы Fe2+, Ru2+) и органическими восстановителями (малоновая кислота, броммалоновая кислота, лимонная кислота, яблочная кислота и др.). При определенных условиях эти системы могут демонстрировать очень сложные формы поведения от регулярных периодических до хаотических колебаний и являются важным объектом исследования универсальных закономерностей нелинейных систем. В частности, именно в реакции Белоусова — Жаботинского наблюдался первый экспериментальный странный аттрактор в химических системах и была осуществлена экспериментальная проверка его теоретически предсказанных свойств.
В упрощенной схеме реакция Белоусова состоит из двух стадий. В первой стадии трехвалентный церий Ce3+ (розовый цвет) окисляется бромноватой кислотой HBrО3, что приводит к избытку ионов Се4+ (голубой цвет):
Се3+  Се4+.
Се4+.
Во второй стадии четырехвалентный церий Се4+ восстанавливается органическим соединением - малоновой кислотой (МК), т. е.
Се4+  Се3+,
Се3+,
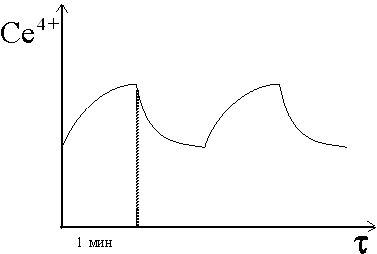
и голубой цвет сменяется розовым. Этот процесс так и продолжается: розовый, голубой, розовый, голубой и т. д. с периодичностью, равной 1 мин (рис. 2). Периодический процесс прекращается после большого числа периодов из-за необратимого расходования бромата BrO3.
Колебания концентрации Се4+ в реакции БЖ.
Рис.2
Жаботинский описал широкий класс химических волновых явлений, в которых наблюдалась пространственно-временная упорядоченность. При этом были реализованы как одномерные реакции в тонких трубках, так и двухмерные процессы (тонкие слои раствора между пластинами).
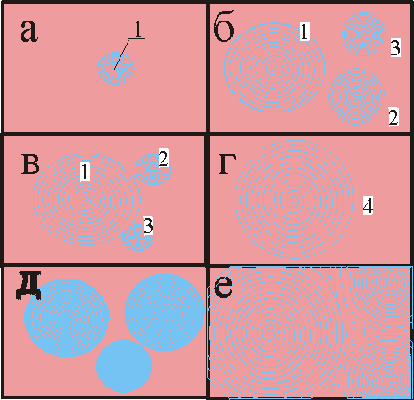
На рис. 3 показано развитие волны при плоской реализации явления: сначала (а) возникает центр 1 изменения окраски, он появляется из-за локальной флуктуации концентрации; одновременно (б) возникают и новые концентрационные центры 2 и 3, последние потом могут быть поглощены (в) волнами от центра 1 и способствовать развитию (г) волновой концентрационной структуры 4. Возможен вариант (д и е) появления более сложной картины от многих начальных центров.
Последовательные кадры волновых химических процессов в тонких слоях раствора (двумерные системы)
Пространственно-временная упорядоченность может рассматриваться как автоколебательные и автоволновые процессы. Эти процессы поддерживаются за счет оттока энтропии из системы. При этом могут образовываться спиральные волны, они носят название ревербераторов. Такого типа образования довольно часто встречаются в биологических системах, например, в строении лишайников.
В работах И. Пригожина подчеркивается связь между физико-химическими процессами в открытых неравновесных процессах и биологической упорядоченностью.
Ключевые слова
Разделы наук
Применение эффекта
Реакция Белоусова — Жаботинского стала одной из самых известных в науке химических реакций, её исследованиями занимаются множество учёных и групп различных научных дисциплин и направлений во всём мире: математики, химии, физики, биологии. Обнаружены ее многочисленные аналоги в разных химических системах (см., например, твердофазный аналог - самораспространяющийся высокотемпературный синтез). Опубликованы тысячи статей и книг, защищено множество кандидатских и докторских диссертаций. Открытие реакции фактически дало толчок к развитию таких разделов современной науки, как синергетика, теория динамических систем и детерминированного хаоса.
Механизм реакции можно изобразить мнемонической схемой (рис. 1), где автокатализатор НВrO3 обеспечивает непосредственную положительную обратную связь (отмечена знаком +), а ингибитор замыкает петлю отрицательной обратной связи ( - ).
Схема реакции Белоусова - Жаботинского
Рис.1
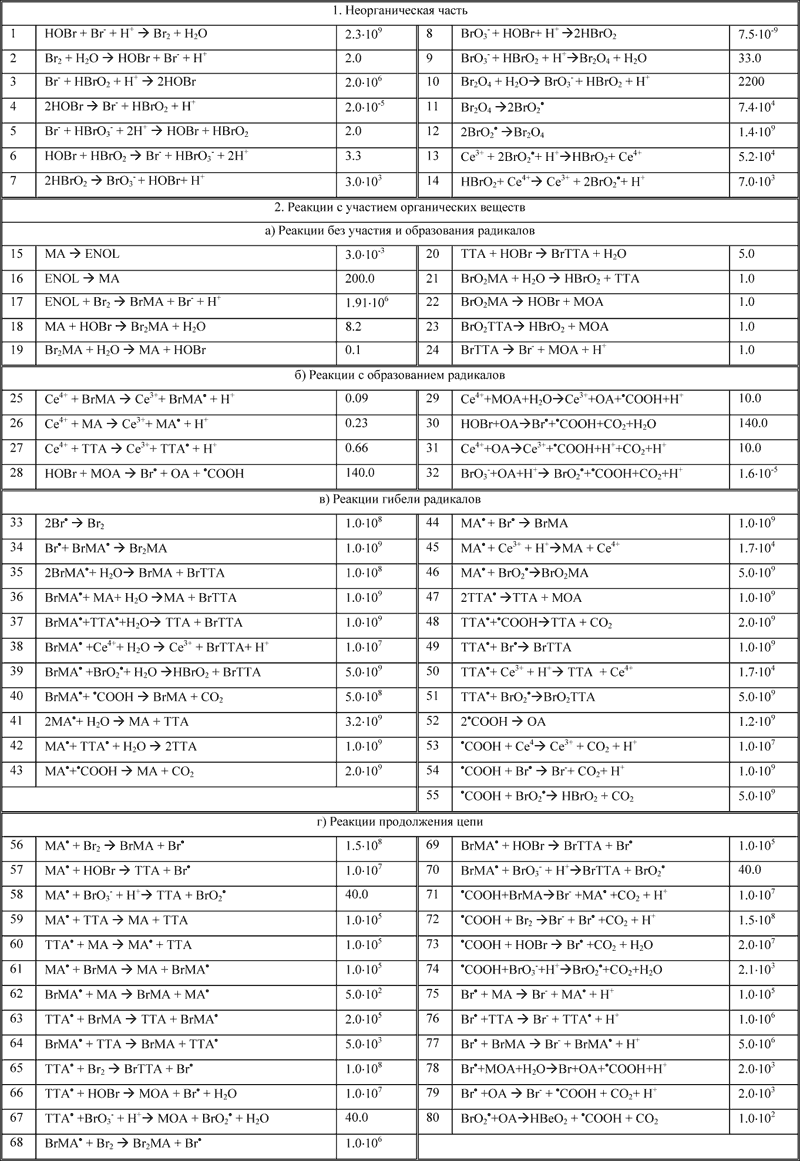
Наиболее полный известный реакционный механизм представляет собой набор 80-ти элементарных реакций (рис.2).
80-ти стадийный механизм реакции Белоусова-Жаботинского
Рис.2
Реализации эффекта
Первая модель реакции Белоусова — Жаботинского была получена в 1967 году Жаботинским и Корзухиным на основе подбора эмпирических соотношений, правильно описывающих колебания в системе. В ее основе лежала знаменитая консервативная модель Лотки — Вольтерра.
здесь X2 = [Ce4+], C=[Ce4+]0 + [Ce3+]0, X1 — концентрация автокатализатора, X3 = [Br-].
Простейшая модель предложенная Пригожиным, которая имеет колебательную динамику.
I A → X
II B + X → Y + D
III 2X + Y → 3X (автокатализ)
IV X → E
V A + B → E + D
Брюсселятор
Рис.1
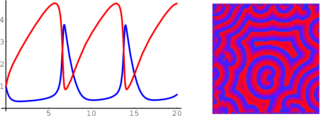
Механизм предложенный Филдом и Нойесом является одним из простейших и в то же время наиболее популярным в работах исследующих поведение реакции Белоусова-Жаботинского:
I. A + Y ⇔ X
II. X + Y ⇔ P
III. B + X ⇔ 2 X + Z
IV. 2 X ⇔ Q
V. Z ⇔ f Y
Соответствующая система обыкновенных дифференциальных уравнений:
Эта модель демонстрирует простейшие колебания похожие на экспериментально наблюдаемые, однако она не способна показывать более сложные типы колебаний, например сложнопериодические и хаос.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Корзухин М. Д., Жаботинский А. М. Математическое моделирование химических и экологических автоколебательных систем. — М.: Наука, 1965.
2. Корзухин М. Д., Жаботинский А. М. Математическое моделирование химических и экологических автоколебательных систем. — М.: Наука, 1965.


 Физико-химические явления
Физико-химические явления Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Жидкости
Жидкости Термодинамика
Термодинамика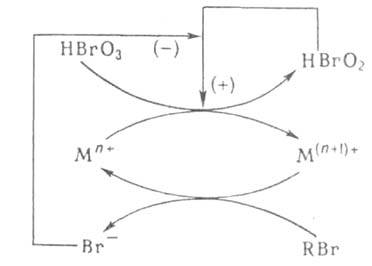
![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Корзухин М. Д., Жаботинский А. М. Математическое моделирование химических и экологических автоколебательных систем. — М.: Наука, 1965.
2. Корзухин М. Д., Жаботинский А. М. Математическое моделирование химических и экологических автоколебательных систем. — М.: Наука, 1965.