|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Температурный скачок в разреженных газах |
 |
Температурный скачок в разреженных газах
Описание
При исследовании газообразного состояния вещества используется молекулярно-кинетическая теория.
Молекулярно-кинетическая теория рассматривает газы как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства газов, особенно полно – свойства разреженных газов.
У достаточно разреженных газов средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 газа находится ~ 1019 молекул и среднее расстояние между ними составляет ~ 10-6см, или ~ 100 A, тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5 – 10 A. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы «собственный объём» всех молекул), составляет 10-3—10-4 от полного объёма газа. Это позволяет считать собственный объём молекул газа в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального газа все направления движения его молекул равновероятны, а скорости распределены в соответствии с распределением Максвелла.
На расстоянии от стенки, равном средней длине свободного пробега молекул, процессы переноса можно считать свободно-молекулярными, и в этой области возникают скачки скорости (скольжение) и температуры.
Молекулярно-кинетическая теория газов с точностью до множителя, близкого к единице, дает значение скольжения и температурного скачка у стенки в виде
Здесь Тг.ст. – температура газа у стенки. Величина ξ=2[2/(α – 1)][κ/(κ+1)] называется коэффициентом скачка. Второй член первого уравнения выражает влияние термомолекулярного течения – движения газа в направлении возрастания температуры.
Как видно из этих формул, скольжение и температурный скачок существуют при любом давлении, проявляясь в
слое Кнудсена толщиной (1÷2)
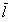
. Так как больших давлениях
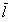
мало, значения ω
s и ΔT, пропорциональные
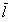
, пренебрежимо малы по сравнению со значением
скорости течения и
температурного напора. На этом и основана гипотеза прилипания газа к стенке в динамике сплошной среды.
При значениях Kn>0,01 выражения можно ввести в граничные условия уравнений Навье – Стокса и энергии и далее искать решение для значений коэффициентов трения и теплообмена.
Многочисленные теоретические исследования в этом направлении основаны на использовании уравнений пограничного слоя с граничными условиями, учитывающими разряжение. Принципиальным здесь является вопрос о возможности такого течения, когда уравнения пограничного слоя остаются справедливыми при наличии влияния скольжения и температуры скачка.
Для разреженного газа вследствие относительно больших размеров возмущенной области первое приближение теории пограничного слоя оправдывается не всегда даже при малых числах Кнудсена.
Как установлено, скачок температуры δT для умеренно разреженных газов пропорционален граденту температуры по нормали к поверхности стенки
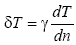
,
а коэффициент
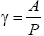
обратно пропорционален давлению газа, т.е.
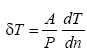
где А - коэффициент пропорциональности.
Ключевые слова
Разделы наук
Применение эффекта
Обычно, измеряя теплопроводность газов при малых давлениях Р << 1 атм, поправку на величину темпратурного скачка δT вводят расчетным путем по формуле
где ΔT = T1 - T2 -измеренная разность между температурами T1 и T2 горячей и холодной поверхностей; t', t'' - температуры газа у горячей и холодной поверхностей; В - коэффициент, величина которого может быть определена расчетным путем по результатам экспериментов с газом при постоянном тепловом потоке д при нескольких значениях давления Р.
Реализации эффекта
Число Кнудсена (Kn) — один из критериев подобия движения разреженных газов,
где λ — средняя длина свободного пробега молекул в газе, L — характерный размер течения (например, длина обтекаемого тела, диаметр трубопровода, диаметр свободной струи), kB — постоянная Больцмана, P — давление, T — температура, σ — поперечный размер частицы.
Названо в честь датского физика Мартина Кнудсена (1871—1949).
Численная величина Kn характеризует степень разреженности газового потока. Если Kn >> 1 (теоретически при Kn → ∞ ), аэродинамические характеристики обтекаемых разреженным газом тел (или течение в вакуумных трубопроводах) можно рассчитывать, не рассматривая столкновений молекул между собой, а учитывая лишь удары молекул о твёрдую поверхность (свободное молекулярное течение). Практически такие методы становятся применимыми и используются уже при Kn ~ 1. Если Kn<<1 (теоретически — при Kn → 0), справедливо основное предположение гидроаэромеханики о сплошности (континуальности) среды и при расчете течения можно пользоваться уравнениями Эйлера или уравнениями Навье — Стокса с соответствующими граничными условиями. Практически эти методы справедливы и используются уже при Kn ~ 10-3.
В области значений числа Кнудсена 10-3 < Kn < 1 реализуются различные промежуточные между свободномолекулярным и континуальным режимы течения разреженного газа с новыми граничными условиями.
Физическая кинетика (греч. κίνησις — движение) — микроскопическая теория процессов в неравновесных средах. В кинетике методами квантовой или классической статистической физики изучают процессы переноса энергии, импульса, заряда и вещества в различных физических системах (газах, плазме, жидкостях, твёрдых телах) и влияние на них внешних полей. В отличие от термодинамики неравновесных процессов и электродинамики сплошных сред, кинетика исходит из представления о молекулярном строении рассматриваемых сред, что позволяет вычислить из первых принципов кинетические коэффициенты, диэлектрические и магнитные проницаемости и другие характеристики сплошных сред. Физическая кинетика включает в себя кинетическую теорию газов из нейтральных атомов или молекул, статистическую теорию неравновесных процессов в плазме, теорию явлений переноса в твёрдых телах (диэлектриках, металлах и полупроводниках) и жидкостях, кинетику магнитных процессов и теорию кинетических явлений, связанных с прохождением быстрых частиц через вещество. К ней же относятся теория процессов переноса в квантовых жидкостях и сверхпроводниках и кинетика фазовых переходов.
Если известна функция распределения всех частиц системы по их координатам и импульсам в зависимости от времени (в квантовом случае — матрица плотности), то можно вычислить все характеристики неравновесной системы. Вычисление полной функции распределения является практически неразрешимой задачей, но для определения многих свойств физических систем, например, потока энергии или импульса, достаточно знать функцию распределения небольшого числа частиц, а для газов малой плотности — одной частицы.
В кинетике используется существенное различие времён релаксации в неравновесных процессах; например, для газа из частиц или квазичастиц, время свободного пробега значительно больше времени столкновения между частицами. Это позволяет перейти от полного описания неравновесного состояния функцией распределения по всем координатам и импульсам к сокращённому описанию при помощи функции распределения одной частицы по её координатам и импульсам.
Физическая кинетика позволяет исследовать явления переноса в разреженных газах, когда отношение длины свободного пробега λ к характерным размерам задачи L (то есть число Кнудсена λ/L) уже не очень малО и имеет смысл рассматривать поправки порядка 1/L (слабо разреженные газы). В этом случае кинетика объясняет явления температурного скачка и течения газов вблизи твёрдых поверхностей.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. Балеску Р. Равновесная и неравновесная статистическая механика. В 2-х томах. — М.: Мир, 1978.
2. Балеску Р. Равновесная и неравновесная статистическая механика. В 2-х томах. — М.: Мир, 1978.


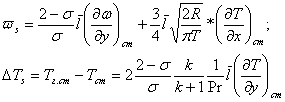
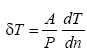
![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. Балеску Р. Равновесная и неравновесная статистическая механика. В 2-х томах. — М.: Мир, 1978.
2. Балеску Р. Равновесная и неравновесная статистическая механика. В 2-х томах. — М.: Мир, 1978.