

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Гей-Люссака закон | |
Анимация
Описание
Закон идеального газа, согласно которому объем данной массы газа при постоянном давлении меняется линейно в зависимости от изменения температуры:
Vt = V0(1+at),
где V0 - объем газа при 00 С;
Vt - объем газа при температуре t, измеренной по шкале Цельсия;
a - термический коэффициент объемного расширения.
a»1/273(°С)-1
Закон Гей-Люссака может быть записан в виде:
V=V0aT,
где Т - абсолютная температура, выраженная в К (Кельвинах);
V0 - объем газа при Т = 273 К.
Очевидно, закон Гей-Люссака неприменим вблизи абсолютного нуля температуры.
Зависимость объема газа от температуры при постоянном давлении представлена на рис. 1.
Изобары идеального газа
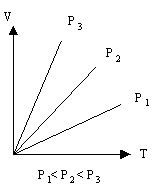
Рис. 1
Поскольку закон Гей-Люссака справедлив для идеальных газов, реальные газы подчиняются ему в достаточно разреженном равновесном состоянии, когда давление и температура далеки от критических значений, при которых начинается cжижение.
Для большинства газов при комнатной температуре давление может изменяться от 10-6 до 102 атм.
Закон носит эмпирический характер, т.к. был получен путем обобщения результатов физических экспериментов.
Закон был опубликован в 1802 г. Жозефом Луи Гей-Люссаком (1778-1850). При этом Гей-Люссак настоял на том, чтобы он носил имя Жака Александра Цезара Шарля (1746-1823), который открыл этот закон в 1787 году, но не опубликовал его.
Ключевые слова
Разделы наук
Применение эффекта
Газовый термометр постоянного давления используют в лабораторной практике для градуировки термометров по шкале Кельвина.
Кроме того, на том же принципе основано устройство термоскопа (рис. 2) - малого тела, служащее для констатации одинаковости или различия температур двух или нескольких тел.
Принципиальные схемы термоскопа
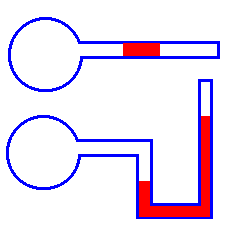
Рис. 2
Термоскоп представляет собой полый стеклянный шар малого объема, соединенный с тонкой стеклянной трубкой, в которой имеется пробка из жидкости (ртути).
При соприкосновении шарика термоскопа с исследуемым телом меняется объем содержащегося внутри него воздуха. Изменение объема воздуха констатируется с помощью жидкостного манометра или по перемещению столбика ртути в трубке, соединенной с шариками.
Реализации эффекта
Газовый термометр постоянного давления
Техническая реализация - газовый термометр постоянного давления. Предложен в 1851 г. Уильямом Томсоном (лордом Кельвином) для реализации абсолютной шкалы температур. В качестве рабочего тела был выбран воздух, но может быть пригоден любой другой газ, вдали от точки ожижения.
Литература
![]() 1. Сивухин Д.В. Общий курс физики.- М.: Наука, 1979.- Т.2. Термодинамика и молекулярная физика.- С.18-28.
1. Сивухин Д.В. Общий курс физики.- М.: Наука, 1979.- Т.2. Термодинамика и молекулярная физика.- С.18-28.
![]() 2. Липман Г. Великие эксперименты в физике; Пер. с англ.- М.: Мир, 1972.- С.45-58.
2. Липман Г. Великие эксперименты в физике; Пер. с англ.- М.: Мир, 1972.- С.45-58.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |