

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Электрическая поляризация | |
Описание
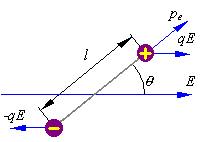
где q – абсолютная величина суммарного положительного, а также суммарного отрицательного зарядов, расположенных, соответственно, в центрах тяжести этих зарядов;
l – расстояние между центрами, тяжести положительных и отрицательных зарядов.
Диэлектрик называется неполярным (неполярный диэлектрик), если электроны атомов в его молекулах расположены симметрично относительно ядер (H2, O2, CCl4 и др.). В таких молекулах центры тяжести положительных и отрицательных зарядов совпадают в отсутствие внешнего электрического поля (l = 0) и дипольный момент pe молекулы равен нулю. Если неполярный диэлектрик помещен во внешнее электрическое поле, то происходит деформация электронных оболочек в атомах (молекулах) и центры тяжести положительных и отрицательных зарядов смещаются друг относительно друга. В молекуле (атоме) диэлектрика возникает индуцированный (наведенный) дипольный электрический момент, пропорциональный напряженности Е электрического поля:
pe=e0aE,
где a – коэффициент поляризуемости молекулы (атома);
e0=8.85Ч10-12 Ф/м – электрическая постоянная в СИ.
![]()
Представим себе, что можно найти “центры тяжести” отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы.
Одну группу составляют те, в молекулах которых оба “центра тяжести” совпадают. Такие молекулы называются неполярными. К ним относятся все ковалентные двухатомные молекулы, а также молекулы, состоящие из трех и более атомов, имеющие высокосимметричное строение, например СО2, СS2 , СCl4 , С6 H6.
Во вторую группу входят все вещества, у которых “центры тяжести” зарядов в молекуле не совпадают, молекулы которых характеризуются электрической асимметрией. Эти молекулы называют полярными. К ним относятся молекулы вида АВ, в которых элементы А и В имеют различную электроотрицательность, и многие более сложные молекулы. Систему из двух разноименных электрических зарядов, равных по абсолютной величине, называют диполем.
Полярность молекулы (и полярность связи) характеризуется дипольным моментом молекулы (или связи). Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул. Полярные молекулы поляризуются в электрическом поле, устанавливаясь по силовым линиям поля, ориентируются в электических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя.
Принимаем e равным заряду электрона(1,6021*10 – 9 Кл) и тогда получаем приведенную длину диполя l, которая является условной величиной. В качестве единицы измерения дипольных моментов принят Дебай (названный в честь голландского физика П.Дебая, разработавшего теорию полярных молекул) в системе СИ 1D=0,33*10-29Кл*м.
Энергия электрического поля в конденсаторе U выражается соотношением:
U=1/2cV2,
где V – напряжение на обкладках конденсатора.
Из приведенного уравнения видно, что конденсатор в среде вещества имеет больший запас энергии, чем в вакууме (с>1). Это обусловлено тем, что под действием электрического поля происходит поляризация среды – ориентация диполей и деформация молекул. Первый эффект зависит от температуры, второй – не зависит.
Не следует путать дипольный момент связи и дипольный момент молекулы, так как в молекуле могут существовать несколько связей, дипольные моменты которых суммируются как векторы. Кроме того, на величину дипольного момента молекулы могут влиять магнитные поля орбиталей, содержащих электронную пару, − "неподеленные"электроны. Большое влияние на полярность молекулы оказывает ее симметрия.
Полярность молекул определяется довольно сложно, так как она учитывает все взаимодействия, которые могут возникнуть в такой сложной
структуре, как молекула. Кроме того, ”полярность” молекулы не определяется лишь величиной дипольного момента, а зависит также от размеров и конфигурации молекул. Например, молекула воды более резко проявляет свои полярные свойства (образование гидратов, растворимость и т.д.), чем молекула этилового спирта, хотя дипольные моменты у них почти одинаковые.
Дипольный момент полярной молекулы может изменять свою величину под действием внешних электрических полей, а также под действием электрических полей других полярных молекул, однако при удалении внешних воздействий дипольный момент принимает прежнюю величину. Некоторые молекулы, неполярные в обычных условиях, могут получать так называемый индуцированный или “наведенный” дипольный момент, тоже исчезающий при снятии поля.
Физико – химические особенности полярных молекул определяются их способностью реагировать на внешние электрические поля (электрическая поляризация) и на поля, созданные другими полярными молекулами. В частности, за счет взаимодействия с полярными молекулами воды такие полярные молекулы, как HF, HCl и др, могут подвергаться электролитической диссоциации.
Ключевые слова
Разделы наук
Применение эффекта
Литература
![]() А.Карапетьян, С.Дракин Общая и неорганическая химия. М., 1989.с ил. Стр. 79.
А.Карапетьян, С.Дракин Общая и неорганическая химия. М., 1989.с ил. Стр. 79.
![]() Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Д.М. Алексеев, А.М. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др.– М.: Большая Российская энциклопедия. Т.I. Ааронова-Бома эффект – Длинные линии. 1998. 704 с., ил. Стр. 575.
Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Д.М. Алексеев, А.М. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др.– М.: Большая Российская энциклопедия. Т.I. Ааронова-Бома эффект – Длинные линии. 1998. 704 с., ил. Стр. 575.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |