

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Ван-дер-Ваальса уравнение | |
Анимация
0
Описание
Простейшим уравнением состояния, описывающим неидеальный газ, является уравнение, предложенное в 1873 г. Иоханнесом Дедериком Ван-дер-Ваальсом (1837 - 1923):
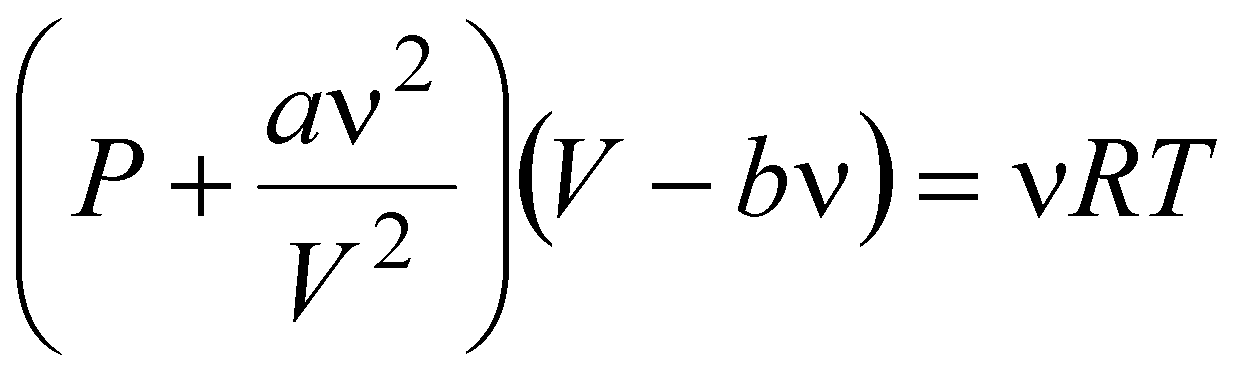 ,
,
где: P, V и T - давление, объём и температура газа;
n - количество молей газа;
a и b - постоянные для данного газа.
Для различных газов a и b различны, и их можно определить экспериментально. Значение константы R такое же, как и для идеального газа. Такой вид уравнения состояния реального газа имеет как экспериментальные, так и молекулярно-кинетические обоснования. Остановимся сначала на последних.
Пусть на молекулы газа действуют силы притяжения и отталкивания. И те, и другие силы действуют на небольших расстояниях, но силы притяжения убывают медленнее сил отталкивания. Силы притяжения относятся к взаимодействию молекулы с её ближайшим окружением, а сила отталкивания проявляется в момент столкновения двух молекул.
Силы притяжения внутри газа в среднем скомпенсированы для каждой отдельной молекулы. На молекулы, расположенные в тонком слое вблизи стенки сосуда, действует сила притяжения со стороны других молекул, направленная внутрь газа, которая создает давление, добавочное к создаваемому самой стенкой. Это давление иногда называют внутренним давлением.
Суммарная сила внутреннего давления, действующая на элемент поверхностного слоя газа должна быть пропорциональна числу молекул газа в этом элементе и также числу молекул в слое газа, непосредственно примыкающему к рассматриваемому элементу поверхностного слоя. Толщина этих слоёв определяется радиусом действия сил притяжения и имеет тот же порядок величины. При увеличении концентрации молекул газа в n раз, сила притяжения, приходящаяся на единицу площади приповерхностного слоя, возрастёт в n2 раз. Поэтому величина внутреннего давления растёт пропорционально квадрату концентрации молекул газа. Тогда для суммарного давления Pў можно записать:
Pў = P + a0ЧN2/V2,
где P - давление газа, которое действует на стенку сосуда (по третьему закону Ньютона стенка действует на газ с тем же давлением);
a0 - постоянная, определяемая физико-химическими характеристиками молекул газа;
N - число молекул газа в объеме;
N/V - отношение представляющее собой концентрацию молекул газа;
Pў - это давление, которое создавал бы идеальный газ при тех же условиях.
Вводя обозначение:
a = a0ЧNA2,
где NA - постоянная Авогадро;
имеем:
Pў = P + a0n2/V2.
Итак, нами получен вид поправки к давлению, которая необходима для того, чтобы учесть слабые силы притяжения в реальном газе, отличающие его от идеального. При этом в формуле для нахождения суммарного давления газа Pў появилась новая постоянная a, зависящая от свойств газа.
Рассмотрим теперь поправку, связанную с действием сил отталкивания. Поскольку нами будут учитываться только парные взаимодействия между молекулами, то эта сила, в отличие от силы притяжения, не будет зависеть от концентрации молекул. По этой же причине сила отталкивания проявляется во всём объёме газа, а не только в приповерхностном слое. Величина этой силы определяет эффективное сечение взаимодействия молекул, то есть, по сути, их размеры.
Таким образом, в случае проявления короткодействующих сил отталкивания, мы не можем аппроксимировать молекулы материальными точками и пренебречь их размерами. Поэтому необходимо ввести поправку, учитывающую объём, занимаемый молекулами. Её величина будет пропорциональна общему числу молекул N, а также зависеть от их физико-химических свойств. Тогда свободный от молекул объем Vў можно определить следующим образом:
Vў = V - b0ЧN,
где b0 - коэффициент, определяемый свойствами молекул.
Вводя обозначение:
b = b0ЧNA,
представим формулу для объема в виде:
Vў = V - bЧn.
Величину bЧn и, таким образом, величину эффективного объёма, занимаемого молекулами, нельзя получить из простых механических моделей, так как сами размеры молекул определяются характером сил отталкивания. Поскольку уравнение Ван-дер-Ваальса является по сути своей эмпирическим, коэффициент b так же как и коэффициент a, должны определяться в первую очередь экспериментально.
Теперь, если в левой части уравнения Клапейрона-Менделеева:
PV = nRT
произвести замену произведения PV на произведение:
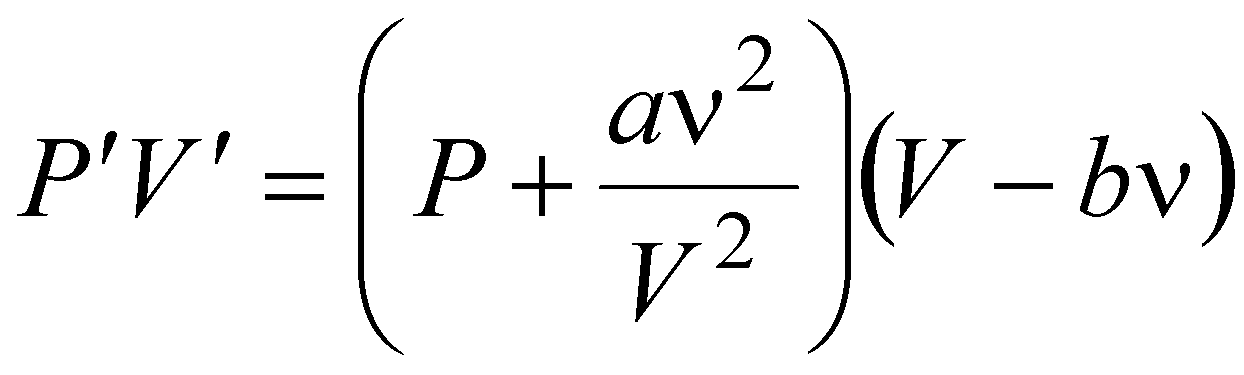 ,
,
то получится уравнение Ван-дер-Ваальса.
Отметим, что проводить замену объема V на Vў в формуле для давления Pў нет необходимости, так как константы a и b достаточно малы. Например, для азота и кислорода a = 0,14 НЧм4/моль2. Коэффициент b для азота и кислорода соответственно имеет значение: 39Ч10 -6 м3/моль и 32Ч10 -6 м3/моль.
Введение поправки, обусловленной действием сил притяжения, привело к тому, что уравнение состояния стало кубическим относительно объёма, а число постоянных, являющихся его параметрами, стало равно трем. Как известно, кубическое уравнение имеет три корня. Для уравнения Ван-дер-Ваальса имеют место два следующих случая:
а) корни действительны;
б) два корня мнимые и один корень действительный.
На рис. 1 изображены изотермы газа Ван-дер-Ваальса для различных температур.
Изотермы газа Ван-дер-Ваальса
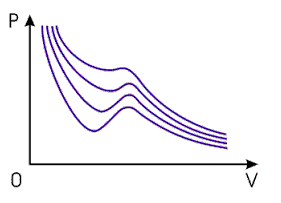
Рис. 1
На этих изотермах хорошо просматривается участок, где давление растёт с ростом объёма. Этот участок не имеет физического смысла. В области, где изотерма делает зигзагообразный изгиб, изобара пересекает её три раза, то есть, имеется три значения объёма V при одинаковых значениях параметров P и T. Это соответствует существованию трёх действительных корней уравнения Ван-дер-Ваальса. При повышении температуры волнообразный участок уменьшается и превращается в точку. Эта точка называется критической, а значение P, V и T в этой точке называются критическими параметрами. Критической точке соответствуют три совпадающих корня уравнения Ван-дер-Ваальса. При температурах, превышающих критическую, изотермы Ван-дер-Ваальса становятся монотонно убывающими функциями P(V).
Критические параметры Pcr, Vcr и Tcr можно найти из условия, что в критической точке изотерма Ван-дер-Ваальса имеет как экстремум, так и точку перегиба:
![]() ,
,
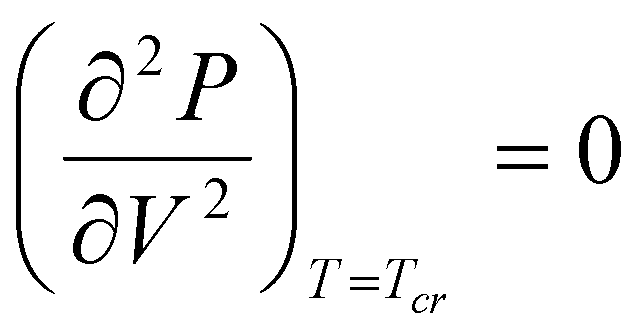 .
.
Решая эти два уравнения совместно с уравнением Ван-дер-Ваальса, можно получить:
Pcr = 1/27Ч(a/b2),
Vcr = 3b,
Tcr = 8/27Ч(a/Rb).
Таким образом, из уравнения состояния газа Ван-дер-Ваальса следует существование у реальных газов критической точки с параметрами Pcr, Vcr и Tcr, величина которых зависит от свойств газа.
Обратимся теперь к экспериментальным обоснованиям уравнения состояния газа Ван-дер-Ваальса. На рис. 2 показан вид экспериментально получаемых изотерм, характерный для многих веществ.
Изотермы реального газа

Рис. 2
На этих кривых виден горизонтальный участок, который заменяет немонотонный участок на изотермах газа Ван-дер-Ваальса. Справа от горизонтального участка экспериментальная изотерма монотонно растет с уменьшением объема, что соответствует сжатию реального газа при постоянной температуре. Горизонтальный участок соответствует ожижению газа, которое при заданной температуре происходит при постоянном давлении. При этом существует двухфазная система жидкость-газ.
Наконец, слева от горизонтального участка, где изотерма вновь становится монотонно убывающей функцией P(V) весь газ превращается в жидкость. При этом давление очень резко растет с уменьшением объема, что связано с тем, что размеры молекул жидкостей сравнимы с межмолекулярными расстояниями. Этот участок экспериментальных изотерм наиболее сильно отличается от предсказываемого уравнением для газа Ван-дер-Ваальса.
Экспериментально изотермы могут быть получены при изотермическом сжатии газа в системе, состоящей из сосуда с поршнем, соединенной с манометром. Семейство изотерм для углекислого газа было построено Томасом Эндрюсом (1813 - 1885) во второй половине XIX века, что имело большое историческое значение. Было установлено, что при температуре выше 31,1 °С углекислота продолжает оставаться газообразной при любом давлении. При более низкой температуре углекислый газ при сильном сжатии переходил в жидкое состояние.
В первой половине XIX века предполагали существование абсолютных газов, которые не могут быть ожижены ни при каких условиях. Однако опыт показал, что любое вещество может быть ожижено при достаточно высоком давлении и низкой температуре.
Совокупность участков изотерм реального газа, соответствующих двухфазным системам жидкость-газ, образуют колоколообразную фигуру, вершиной которой является критическая точка. При температурах выше критической вещество может существовать только в газообразном состоянии. При температуре ниже критической, вещество может быть ожижено. Критическая температура гелия очень низкая - 5,2 К. Поэтому долгое время его считали абсолютным газом. Впервые жидкий гелий был получен Гейке Камерлинг-Оннесом (1853 - 1926) в 1908 году. Эта дата считается датой рождения физики низких температур.
В отличие от гелия, водорода, кислорода и азота, чьи критические температуры достаточно низкие, такие вещества как вода и ртуть (критические температуры 647 К и 1820 К соответственно) как в жидком, так и в газообразном состояниях при комнатных температурах. Поэтому возникли такие термины как “водяной пар” и “пары ртути”. Сегодня, с исчезновением понятия “абсолютный газ”, исчезло различие понятий “газ” и ”пар”.
Для нахождения внутренней энергии газа Ван-дер-Ваальса воспользуемся следующим приемом. Пусть над газом Ван-дер-Ваальса осуществляется процесс без теплообмена с окружающей средой. Тогда изменение его внутренней энергии можно записать в виде:
dU = -dA = -PdV.
При тех же условиях изменение внутренней энергии идеального газа можно было бы рассчитать по формуле:
dU ў = -PўdVў,
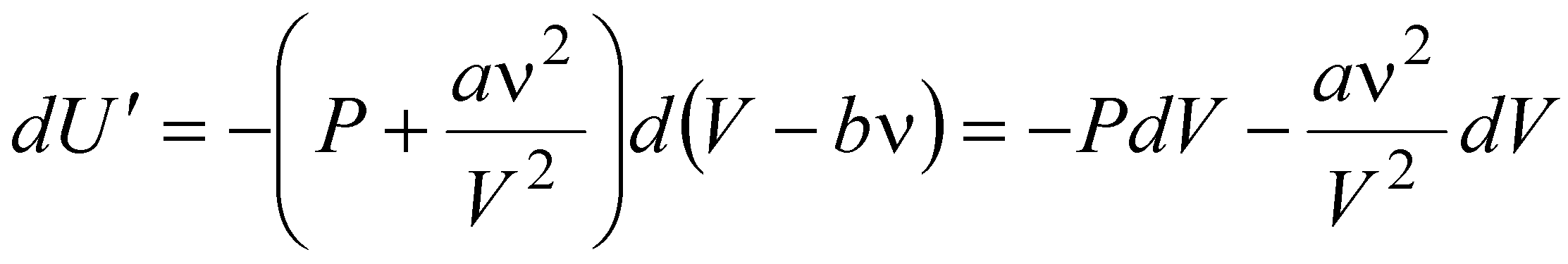 .
.
Первое слагаемое в выражении представляет собой изменение внутренней энергии газа Ван-дер-Ваальса.
Отсюда следует:
dU = dU ў + (an2/V2)dV.
Интегрирование этого выражения дает:
U = U ў - an2/V + const.
Здесь произвольную константу интегрирования необходимо положить равной нулю, так как в пределе при V ® Ґ выражения для внутренних энергий газа Ван-дер-Ваальса и идеального газа должны совпадать:
U = U ў.
Можно записать формулу, для расчета внутренней энергии газа Ван-дер-Ваальса:
U = nCvЧT - an2/V.
Как следует из этого выражения, внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине, при осуществлении изотермических процессов в газе Ван-дер-Ваальса будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Ключевые слова
Разделы наук
Применение эффекта
Практическое применение уравнения Ван-дер Ваальса связано обычно с применением эффекта Джоуля-Томсона для получения жидких газов, которые в нормальных условиях находятся вдалеке от критической точки.
В конце XIX века Линде разработал машину для ожижения воздуха, в которой охлаждённый вследствие эффекта Джоуля-Томсона воздух осуществляет предварительное охлаждение следующей порции воздуха, которая затем в свою очередь расширяется с уменьшением температуры. Повторяя процесс многократно, можно получить температуру воздуха ниже критической и ожижить его. Используя схему Линде, Камерлинг-Оннес в 1908 году получил жидкий гелий, что стало началом новой области физики - физики низких температур.
Для получения жидкого гелия потребовалось предварительно охладить его жидким водородом. Для получения жидкого водорода также потребовалось его предварительное охлаждение жидким воздухом. Это объясняется тем, что расширение сжатых (как правило до нескольких десятков атмосфер) гелия и водорода при комнатной температуре сопровождается увеличением их температуры. Предварительное охлаждение позволяет пройти точку инверсии и получить уменьшение температуры. Предварительное охлаждение позволяет пройти точку инверсии и получить уменьшение температуры в эффекте Джоуля-Томсона.
В 30-е годы прошлого столетия Петром Леонидовичем Капицей был разработан более эффективный способ получения сжиженных газов, в котором газ при адиабатическом расширении совершает положительную работу, т. е. его внутренняя энергия уменьшается. Созданное Капицей устройство называется турбодетандером, т. к. газ совершает работу по вращению теплоизолированной турбины.
Схема машины Линде, служащей для получения жидкого воздуха представлена на рис. 3.
Схема машины Линде
Рис. 3
Двухцилиндровый компрессор, пpиводимый в движение электромотором, сжимает воздух до давления порядка 100 am. Сжатый воздух поступает в змеевик. Этот змеевик состоит из нескольких труб, вставленных одна в другую. Сжатый компрессором воздух проходит по самой внутренней трубе и, достигая вентиля, внезапно расширяется. При этом его температура (воздух имеет при этих условиях положительный эффекг Джоyля-Томсона) падает. Получившаяся порция холодного воздуха поднимается по внешней трубе змеевика и охлаждает встречную порцию воздуха, идущего по внутренней трубе от компрессора. Эта вторая порция сжатого воздуха, таким образом, отчасти охлаждается еще раньше, чем она достигнет вентиля. Расширяясь при прохождении через вентиль, она еще сильнее охлаждается благодаря эффекту Джоуля-Томсона.
Этот процесс, повторяемый достаточное число раз, ведет к охлаждению воздуха до температуры ниже его критической температуры и к его сжижению.
Жидкий воздух собирается в дюаровском сосуде, в котором он, благодаря слабому притоку извне тепла, может сохраняться достаточно долго.
Реализации эффекта
Джоуль и Томсон модифицировали опыты Гей-Люссака и обнаружили, что температура реальных газов при их расширении в условиях энергетической изоляции изменяется, причём, может как повышаться, так и понижаться. Это явление, полностью основанное на уравнении Ван-дер-Ваальса получило название эффекта Джоуля-Томсона.
Если потенциальная энергия взаимодействия молекул реального газа при расширении возрастает, то его температура при этом падает. Если потенциальная энергия уменьшается - температура растёт. В частности, для газа Ван-дер-Ваальса, если силы притяжения играют более существенную роль, чем силы отталкивания, то газ при расширении охлаждается, если силы отталкивания превосходят силы притяжения - температура уменьшается.
Рассматривая уравнения состояния мы можем сформулировать это так: если внутренним давлением a/V2 можно пренебречь по сравнению с поправкой объёма, то эффект Джоуля-Томсона будет происходить с уменьшением температуры газа Ван-дер-Ваальса. Если наоборот - с увеличением температуры как мы уже отмечали, значения параметров а и b определяются сортом молекул газа и могут быть определены из таблиц физических величин. Таким образом, знак эффекта Джоуля-Томсона будет зависеть от объёма и давления газа Ван-дер-Ваальса. Значения Р и V, при которых эффект Джоуля-Томсона не наблюдается, получили названия точек инверсии, а их совокупность - кривой инверсии.
Литература
![]() 1. Сивухин Д.В. Общий курс физики. - М.: Наука, 1980. - Т. 2. Термодинамика и молекулярная физика. - С. 18-20.
1. Сивухин Д.В. Общий курс физики. - М.: Наука, 1980. - Т. 2. Термодинамика и молекулярная физика. - С. 18-20.
![]() 2. Фриш С.Э., Тиморева А.В. Курс общей физики. - М.: Физматгиз, 1959. - Т. 1.- С. 464.
2. Фриш С.Э., Тиморева А.В. Курс общей физики. - М.: Физматгиз, 1959. - Т. 1.- С. 464.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |