

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Хемилюминесценция | |
Анимация
0
Описание
Хемилюминесценция заключается в испускании люминесцентного излучения продуктами химических реакций или другими компонентами, возбуждаемыми за счёт переноса энергии к ним от продуктов реакций. Хемилюминесценция сопровождает газофазные, жидкофазные и гетерогенные окислительно-восстановительные реакции идущие как самопроизвольно, так и происходящие под воздействием различных факторов: электрического разряда, света, ионизирующего излучения и др. Возникновение хемилюминесценции возможно, если в ходе реакции образуются активные в термодинамическом и кинетическом отношении частицы, например, радикалы, т.е. молекулярные частицы, содержащие неспаренные электроны.
Большинство химических реакций, сопровождаемых хемилюминесценцией, являются реакциями каталитического окисления различных веществ перекисью водорода, кислородом или галогенами. Катализаторами являются тяжёлые металлы, комлексные соли и некоторые биологически активные органические вещества, например, гемин, каталаза. Каталитическое усиление хемилюминесценции металлами наиболее эффективно в случае, если металл применяется в виде комплесного соединения, в котором часть координационных мест остаётся свободной.
Яркость хемилюминесценции зависит от скорости реакции (которая, в свою очередь, пропорциональна произведению концентраций компонентов) и квантовой эффективности хемилюминесценции (числу квантов на один акт реакции). На рис. 1 показана зависимость яркости хемилюминесценции от концентрации одного из компонентов реакции.
Зависимость яркости хемилюминесценции от концентрации одного из компонентов реакции
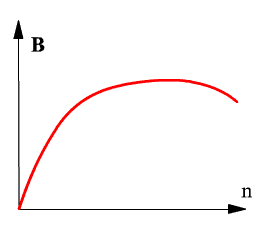
Рис. 1
Обозначения:
B - яркость свечения;
n - концентрация компонента.
При увеличении концентрации реагирующих компонентов или катализатора увеличивается вероятность образования активных радикальных форм. Предел увеличения концентрации радикалов обусловлен их рекомбинацией. Скорость рекомбинации радикалов зависит от свойств реакционной среды, в частности, от способности растворителя к безилучательному рассеянию энергии, получаемой им при рекомбинации радикалов. Поэтому при увеличении концентрации компонентов яркость свечения повышается до определённого предела и при дальнейшем росте концентрации остаётся неизменной или даже уменьшается.
При избытке одного из компонентов реакции увеличение концентрации этого компонента не увеличивает выхода продукта реакции, а значит, и яркости свечения.
В большинстве реакций эффективность хемилюминесценции не превосходит 1 %. Высокая эффективность хемилюминесценции характерна для окисления гидразидов, силоксенов, углеводородов и соединений фосфора, достигая 30 % для первых двух групп веществ.
Спектры хемилюминесценции близки к спектрам фотолюминесценции, возбуждаемой ультрафиолетовым излучением.
Частным случаем хемилюминесценции является биолюминесценция.
Ключевые слова
Разделы наук
 Физико-химические явления
Физико-химические явления Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Излучение и детектирование света
Излучение и детектирование света
Применение эффекта
Пример использования в технике - хемилюминесцентный анализ.
В биохимических исследованиях широко используется количественная аналитическая реакция для обнаружения пероксида водорода в биологических объектах, предложенная Лагенбеком и Руге. 100 мг гидразида 3-аминофталевой кислоты растворяют в 100 мл 1 % раствора карбоната натрия с добавлением 2 мг хлоргемина. При добавлении в полученный реактив пероксида водорода возникает хемилюминесцентная реакция. Минимально определяемое количество пероксида водорода порядка 10-10 моль/м3. Поскольку образующийся в живом организме пероксид водорода непрерывно разлагается под действием катализаторов и восстановителей и не может накапливаться в организме, реакция, позволяющая определять малые количества этого продукта, представляет существенный интерес.
При замене в указанном выше реактиве раствора карбоната натрия на 20 мл 5 % раствора гидроксида натрия получают реактив, получивший название “люминол”. Свечение, возникающее в процессе реакции люминола и пероксида водорода, усиливается в присутствии гемина, входящего в состав крови. Эта реакция используется для обнаружения пятен крови.
Аналогичная реакция позволяет определить наличие следов меди в исследуемом образце.
Фосфорорганические отравляющие вещества катализируют хемилюминесцентную реакцию окисления индола перборатом натрия.
Для аналитических целей интересны все участки графика концентрационной зависимости яркости хемилюминесцентного излучения. Участок подъёма важен как интервал, в котором можно количественно определять концентрацию соответствующего компонента. Горизонтальный участок характеризует достижение оптимальных условий чувствительности реакции.
Реализации эффекта
В биохимических исследованиях широко используется количественная аналитическая реакция для обнаружения пероксида водорода в биологических объектах, предложенная Лагенбеком и Руге. 100 мг гидразида 3-аминофталевой кислоты растворяют в 100 мл 1 % раствора карбоната натрия с добавлением 2 мг хлоргемина. При добавлении в полученный реактив пероксида водорода возникает хемилюминесцентная реакция.
Литература
![]() 1. Физика. Большой энциклопедический словарь.- М.: Большая Российская энциклопедия, 1998.- С.824.
1. Физика. Большой энциклопедический словарь.- М.: Большая Российская энциклопедия, 1998.- С.824.
![]() 2. Бабко А.К., Дубовенко Л.И., Луковская Н.М. Хемилюминесцентный анализ.- Киев: Техника, 1966.- С.250.
2. Бабко А.К., Дубовенко Л.И., Луковская Н.М. Хемилюминесцентный анализ.- Киев: Техника, 1966.- С.250.
![]() 3. Люминесцентный анализ. Под ред. М.А.Константиновой-Шлезингер.- М.: Гос. изд-во физ.-мат. лит-ры, 1961.- С.400.
3. Люминесцентный анализ. Под ред. М.А.Константиновой-Шлезингер.- М.: Гос. изд-во физ.-мат. лит-ры, 1961.- С.400.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |