

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Электролиз | |
Анимация
0
Описание
Электролизом называют химические превращения одних веществ в другие, происходящие в электролитах (растворах или расплавах, содержащих ионы) при пропускании через них постоянного тока. В сосуд с электролитом опускают два металлических (или угольных) проводника, называемых электродами, и соединяют их с положительным (анод) и отрицательным (катод) полюсами источника тока. Такую систему называют электролизером (электролитической или гальванической ванной) (рис. 1).
Принципиальная схема электролизера
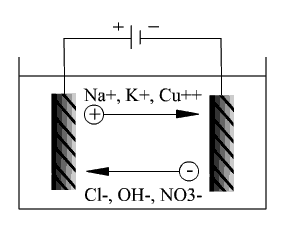
Рис. 1
Положительно заряженные ионы (катионы) - это ионы металлов и водорода - достигают катода и забирают у него избыточные электроны, превращаясь в нейтральные атомы. Отрицательно заряженные ионы (анионы) - это радикалы, галогены и др. - достигая анода, отдают ему свои электроны, превращаясь в новые вещества - продукты окисления. Таким образом, основа процесса электролиза - это анодное окисление и катодное восстановление.
Типичными примерами могут служить два типа реакций при использовании электродов из химически нейтрального материала (платина). Пусть электролитом является раствор HCl. Ионы Cl-, двигаясь к аноду, отдают ему электроны, превращаясь в нейтральные атомы Сl:
Cl- → Cl + e-
где e - электрон.
На катоде ионы Н+, забирая у него электроны, превращаются в атомы Н:
Н+ + е- → Н.
Атомы Сl и Н неустойчивы и соединяются попарно в молекулы Сl2 и Н2, и на аноде выделяется газообразный хлор, а на катоде - водород.
Второй тип реакций при инертных электродах - электролиз водного раствора CuCl2.
Анодные процессы - те же самые, а на катоде происходит превращение ионa Сu++ в
нейтральный атом Сu. В результате на аноде выделяется хлор Cl2, а на катоде осаждается медь.
Результаты электролиза одного и того же раствора могут быть различными в зависимости от материала электродов. Например, реакция диссоциации водного раствора серной кислоты:
![]() .
.
Если в раствор опустить свинцовые электроды, то при пропускании тока на катоде будет выделяться газообразный водород, а на аноде образуется сульфат свинца: SO4 + Pb ® PbSO4. В результате количество серной кислоты будет убывать. При использовании платиновых электродов на катоде по-прежнему будет выделяться водород, а ионы ![]() , отдавая отрицательные заряды аноду, превращаются в радикалы SO4, вступающие в реакцию с водой согласно уравнению:
, отдавая отрицательные заряды аноду, превращаются в радикалы SO4, вступающие в реакцию с водой согласно уравнению:
2SO4 + 2H2O → 2H2SO4 + O2.
В результате вновь будет образовываться серная кислота и выделяться кислород. Таким образом, количество серной кислоты в растворе не меняется. Однако на катоде выделяется водород, а на аноде - кислород. Окончательный итог электролиза сводится к разложению воды на кислород и водород. Число n0 продиссоциировавших молекул кислоты в единице объема воды пропорционально полному числу молекул кислоты в этом объеме: n0 = an, где a - коэффициент пропорциональности.
В общем случае при химически активных электродах и в присутствии посторонних веществ в процессе электролиза могут происходить многообразные, сложные вторичные реакции.
Химические действия электрического тока были известны еще в 18 веке.
В 1833 - 1834 гг. М. Фарадей (M. Faraday, 1791 - 1867) открыл основные количественные законы электролиза, выражающие связь между количеством электричества и количеством и природой веществ, претерпевающих превращения при прохождении тока.
Ключевые слова
Разделы наук
Применение эффекта
Электролиз широко используется в промышленности для производства различных веществ: хлора (мировой объем ≈ 30 млн. тонн в год), щелочи (≈ 35млн. тонн в год), алюминия (≈ 15 млн. тонн в год) и многих других; для рафинирования металлов (степень чистоты 99,9 %); для синтеза некоторых органических соединений; в гальванопластике для получения слоев металлов достаточной толщины с целью воспроизводства формы предмета; в гальваностегии для получения тонких слоев с целью защиты от коррозии, для повышения износостойкости, в декоративных целях.
Реализации эффекта
Схема электролитической установки показана на рис. 2.
Схема электролитической установки
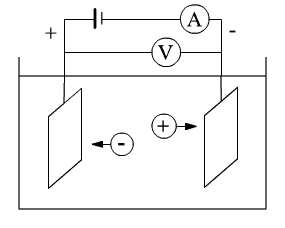
Рис. 2
В некоторой емкости находится электролит и проводящие электроды (металлические или графитовые) различной формы. Электроды подключены к источнику тока. Для измерения силы тока используется амперметр (А), а для измерения напряжения - вольтметр (V). Плотность тока:
j = I /S,
где I - сила тока;
S - площадь электродов.
В зависимости от площади электродов плотность тока может составлять (10 - 104) А/м2 . Напряжение на ванне (2 - 5) В. При последовательном соединении нескольких ванн напряжение составляет (200 - 400) В. В промышленных элетролизерах ток может достигать 100 кА.
Литература
![]() 1. Физическая энциклопедия. - М.: Большая Российская энциклопедия, 1998. - Т. 5.
1. Физическая энциклопедия. - М.: Большая Российская энциклопедия, 1998. - Т. 5.
![]() 2. Киреев В.А. Курс физический химии. - М.: Химия, 1975.
2. Киреев В.А. Курс физический химии. - М.: Химия, 1975.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |