

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Фарадея законы электролиза | |
Анимация
0
Описание
Законы Фарадея количественно описывают закономерности, наблюдающиеся при электролизе - процессе превращения различных веществ при прохождении электрического тока через электролит. Они открыты в 1833-34 гг. английским ученым М. Фарадеем (M. Faraday, 1791 - 1867) в результате анализа опытных данных, полученных им при изучении электролиза различных веществ.
Первый закон: масса m вещества, выделившегося на электроде, пропорциональна количеству электричества (заряду Q), прошедшего через электролит: m = kQ, где k - коэффициент пропорциональности, называемый электрохимическим эквивалентом вещества и зависящий от природы вещества. Он численно равен массе вещества, выделившегося на электроде при прохождении заряда, равного 1 Кл, и выражается в кг/Кл. Элементы, проявляющие в химических соединениях различную валентность, имеют несколько значений электрохимического эквивалента.
Второй закон: электрохимические эквиваленты различных веществ прямо пропорциональны их химическим эквивалентам:
![]() ,
,
где A/n - химический эквивалент;
A - атомная или молекулярная масса ионов, нейтрализующихся на электроде;
n - валентность иона;
F - некоторая постоянная величина, называемая числом Фарадея, одинаковая для всех веществ ( одновалентных).
Законы Фарадея можно выразить одним соотношением - объединенным законом Фарадея:
![]() ,
,
где I - сила тока;
t - время прохождения тока.
Из объединенного закона Фарадея следует, что число Фарадея равно заряду, при прохождении которого через электролит на электроде выделяется 1 моль вещества в расчете на единицу валентности этого вещества. Опытным путем было установлено, что F = 96,5 кКл/моль.
Объединенный закон Фарадея можно вывести, исходя из представлений о том, что каждый ион при электролизе переносит заряд q, кратный некоторому элементарному заряду е: q = nе, где n - валентность иона. Полный заряд, перенесенный N ионами, равен: Q = Nq = Nne. Если mо - масса одного иона, то вся масса вещества, выделившегося на электроде:
![]() ,
,
где NА = 6,023·1023 моль-1.
Таким образом, мы получаем объединенный закон.
При этом число Фарадея оказывается равным F = NAe. Именно по этой формуле еще в 1874 г. был вычислен элементарный заряд - заряд электрона:
e = 96,5Ч103 /(6,023Ч1023) = 1,6Ч10 -19 Кл.
Законы Фарадея были проверены в различных условиях электролиза: при больших и малых силах тока, при высоких и низких температурах, при различных давлениях, при одновременном выделении нескольких веществ на электродах, при проведении электролиза в различных растворителях и в расплавах, при различных концентрациях электролита. Отклонения от закона Фарадея, которые иногда наблюдаются, объясняются тем, что в некоторых электролитах кроме ионной проводимости присутствует еще и электронная проводимость.
Ключевые слова
Разделы наук
Применение эффекта
Электролиз широко используется в промышленности для производства различных веществ: хлора (мировой объем » 30 млн. тонн в год), щелочи (» 35млн. тонн в год), алюминия (» 15 млн. тонн в год). Он также используется для рафинирования металлов (степень чистоты 99,9 %); для синтеза некоторых органических соединений; в гальванопластике для получения слоев металлов достаточной толщины с целью воспроизводства формы предмета; в гальваностегии для получения тонких слоев с целью защиты от коррозии, для повышения износостойкости, в декоративных целях.
Реализации эффекта
Схема электролитической установки показана на рис. 1.
Схема электролитической установки
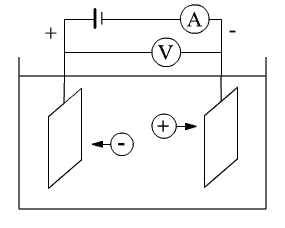
Рис. 1
В некоторой емкости находится электролит и проводящие электроды различной формы (металлические или графитовые). Электроды подключены к источнику тока. Для измерения силы тока используется амперметр (А), а для измерения напряжения - вольтметр (V). Плотность тока j = I/S , где I - сила тока, а S - площадь электродов. В зависимости от площади электродов плотность тока может составлять (10 - 104) А/м2. Напряжение на ванне (2 - 5) В. При последовательном соединении нескольких ванн напряжение составляет (200 - 400) В. В промышленных элетролизерах ток может достигать 100 кА.
Литература
![]() 1. Физическая энциклопедия.- М.: Большая Российская энциклопедия, 1998.- Т.5.
1. Физическая энциклопедия.- М.: Большая Российская энциклопедия, 1998.- Т.5.
![]() 2. Киреев В.А. Курс физический химии.- М.: Химия, 1975.
2. Киреев В.А. Курс физический химии.- М.: Химия, 1975.
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |