|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Закон Мозли |
 |
Закон Мозли
Анимация
Описание
Мозли закон – закон, связывающий частоту спектральных линий
характеристического рентгеновского излучения химического элемента с его порядковым номером в таблице Менделеева. Экспериментально установлен Г. Мозли в 1913. Согласно закону Мозли, корень квадратный из частоты

данной спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера в таблице Менделеева
Z:
где M – постоянная, a – т.н. постоянная экранирования. Атомный номер Z имеет смысл электрического заряда ядра и равен числу протонов в ядре. M и a - константы для линии с данной серией и данным индексом (см. ниже).
Характеристическое рентгеновское излучение возникает следующим образом. Из атома вырывается электрон одной из нижних, заполненных, оболочек. Это может произойти под воздествием кванта излучения с высокой энергией или удара быстрого электрона. Образуется вакантный уровень. Через короткое время на этот уровень переходит электрон с более высокого уровня. Такой процесс понижает потенциальную энергию атома, избыток энергии выделяется в виде кванта света. При обычных условиях (нагрев, химические реакции) в атоме меняются состояния электронов внешней, незаполненной оболочки, т.н. валентных электронов. Эти электроны находятся на верхних энергетических уровнях, для изменения их состояния нужна сравнительно небольшая энергия - кванты света, обладающие такой энергией лежат в оптическом или ближнем ультрафиолетовом диапазоне. В рассматриваемом процессе участвуют электроны заполненных оболочек, которые находятся на нижних энергетических уровнях. Переходы между нижними и верхними уровнями соответствуют квантам высокой энергии - квантам рентгеновского диапазона.
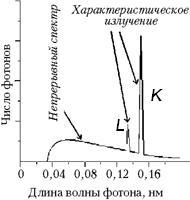
Поскольку характеристическое излучение вызвано переходами между дискретными энергетическими уровнями атома, они имеет линейчатый спектр. На опыте характеристическое излучение наблюдают как резкие пики интенсивности излучения на фоне непрерывного спектра (Рис. 1).
Первые две серии характеристического излучения на фоне непрерывного спектра. Источник излучения - медный электрод.
Рис. 1.
Линии разделены на серии - самая длинноволновая K-серия, более коротковолновая L-серия и т.д. Внутри серии отдельные линии нумеруются греческими буквами. Каждая серия имеет резкую длинноволновую границу, по которой удобно вести измерения и размытую коротковолновую. Наличие серий отражает сложную структуру атомных уровней - так, K-серия возникает при отрыве электрона с самой нижней, K-оболочки (с квантовым числом n=1). На это место может перейти электрон с L-оболочки (n=2), M-оболочки (n=3) и т.д.. Энергия перехода будет разная. Излучение, возникшее из всевозможных переходов с разных оболочек на уровень K-оболочки образует K-серию.
На практике характеристическое излучение получают в т.н. рентгеновских трубках при ударе разогнанных высоким напряжением электронов об анод (см. Реализацию).
Более поздние эксперименты выявили некоторые отклонения от указанной зависимости для переходных групп элементов, связанные с изменением порядка заполнения внешних электронных оболочек, а также для тяжёлых атомов, появляющиеся в результате релятивистских эффектов (условно объясняемых тем, что скорости внутренних сравнимы со скоростью света).
В зависимости от ряда факторов – от числа нуклонов в ядре (изотопический сдвиг), состояния внешних электронных оболочек (химический сдвиг) и прочее – положение спектральных линий на диаграмме Мозли может несколько изменяться. Изучение этих сдвигов позволяет получать детальные сведения об атоме.
Ключевые слова
Разделы наук
Применение эффекта
Измерение атомного номера неизвестного элемента.
Измерение рентгеновского спектра неизвестного элемента и применение закона Мозли позволяет установить число Z для неизвестного элемента. Особую актуальность данный метод имел в период составления периодической таблицы элементов, когда порядок элементов был не ясен. До открытия Мозли измерять можно было только атомный вес. Наличие изотопов приводило к тому, что атомная масса элемента с большим числом Z оказывалась меньше. Дробные значения атомной массы приводили к дискуссиям по поводу места того или иного элемента в таблице Менделеева.
Опыты Мозли позволили установить, например, что число Z для кобальта больше числа Z для железа (26) и меньше числа Z для никеля (28). Тем не менее атомная масса кобальта 58,9 а атомная масса никеля - 58,7. Также опыты Мозли позволили установить пробелы в таблице Менделеева - места для еще не полученных элементов, чего не мог дать метод определения атомной массы. Так, было установлено вакантное место с Z=43 и занятое открытым позже Технецием.
Диагностика сплавов и соединений элементов.
В химических соединениях уровни внешних оболочек изменяются, поэтому по спектру в оптическом диапазоне судить о составе сложного соединения нельзя. Но химические связи практически не затрагивают внутренние оболочки, которые участвуют в создании характеристического излучения. Поэтому рентгеновский спектр элемента в составе сложного соединения будет таким же, как спектр отдельных атомов этого элемента. Таким образом, измерение характеристического излучения и сопоставление с законом Мозли - важный метод диагностики состава сложных соединений.
Реализации эффекта
На практике рентгеновский спектр удобно наблюдать, используя т.н. рентгеновские трубки. В этом устройстве присутствует пара электродов, на которые подается высокое напряжение (десятки кВ). Газ из трубки откачивается, организуется эмиссия электронов из катода - либо непосредственно под действием сильного электрического поля, либо путем нагрева катода. Электроны разгоняются электрическим полем до и ударяют в анод.
Спектр излучения рентгеновской трубки имеет следующую структуру - на фоне сплошного спектра заметны резкие пики - это характеристическое излучение. Сплошной спектр - это тормозное излучение электронов, ударяющих в анод. Его форма не зависит от материала анода. Частоты линий характеристического излучения, напротив, зависят только от материала анода. В данном случае характеристическое излучение имеет следующую природу. Быстрый электрон, разогнанный высоким напряжением, ударяет в анод и может выбить из атома анода электрон с заполненной оболочки. Затем на это место перейдет электрон с более высокого уровня, а разность энергий выделится в виде кванта характеристического излучения.
Проводя опыт с анодом из разных материалов, мы можем построить зависимость частоты характеристической линии (отдельно K-линии, отдельно L-линии и т.д.) от порядкового номера Z элемента, из которого сделан анод. На получившейся диаграмме Мозли (Рис. 1) зависимость частоты характеристических линий от Z представляет собой ряд прямых (К, L, М и т. д. серии, соответствующие значениям n = 1, 2, 3,...). Это экспериментальное подтверждение закона Мозли.
Диаграмма Мозли - зависимость квадратного корня частоты характеристической линии от атомного номера Z.
Рис. 1.
Литература
 Большая Советская энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Н.К.Байбаков, В.Х. Василенко, Л.М. Володарский, В.В. Вольский и др.– М.: Советская энциклопедия. Том 26. Изд. "Советская энциклопедия". 1987 г. 622 с.
Большая Советская энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Н.К.Байбаков, В.Х. Василенко, Л.М. Володарский, В.В. Вольский и др.– М.: Советская энциклопедия. Том 26. Изд. "Советская энциклопедия". 1987 г. 622 с.
 Сивухин Д. В. Общий курс физики. Том 5. Атомная и ядерная физика. М: Физматлит, 2004, 656 С.
Сивухин Д. В. Общий курс физики. Том 5. Атомная и ядерная физика. М: Физматлит, 2004, 656 С.


 Рентгеновское излучение
Рентгеновское излучение Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Излучение и детектирование света
Излучение и детектирование света Электромагнитные колебания и волны
Электромагнитные колебания и волны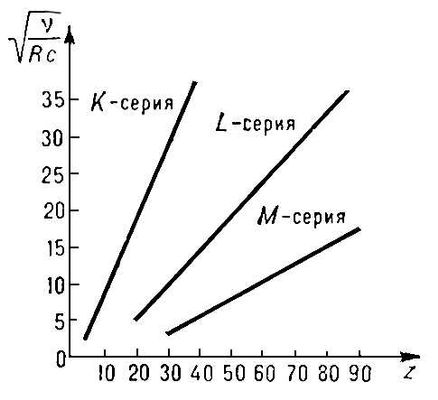
![]() Большая Советская энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Н.К.Байбаков, В.Х. Василенко, Л.М. Володарский, В.В. Вольский и др.– М.: Советская энциклопедия. Том 26. Изд. "Советская энциклопедия". 1987 г. 622 с.
Большая Советская энциклопедия / Гл. ред. А.М. Прохоров. Ред. кол.: Н.К.Байбаков, В.Х. Василенко, Л.М. Володарский, В.В. Вольский и др.– М.: Советская энциклопедия. Том 26. Изд. "Советская энциклопедия". 1987 г. 622 с.
![]() Сивухин Д. В. Общий курс физики. Том 5. Атомная и ядерная физика. М: Физматлит, 2004, 656 С.
Сивухин Д. В. Общий курс физики. Том 5. Атомная и ядерная физика. М: Физматлит, 2004, 656 С.