|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Сорбция |
 |
Поглощение телом газов, паров или растворов из окружающей среды
Анимация
Описание
Под сорбцией понимают поглощение твердым телом или жидкостью жидкого вещества или газа из окружающей среды. Сорбентом называют вещество, на котором происходит процесс сорбции, а сорбатом – сорбирующееся вещество. Выделяют несколько видов сорбционных процессов. Абсорбция – поглощение вещества из газовой фазы всем объемом жидкого сорбента. Адсорбция – поглощение вещества поверхностным слоем сорбента. Поглощение вещества из газовой фазы всем объемом твердого тела или расплава называется окклюзией. Извлечение из жидкости какого-либо компонента другой жидкостью называется экстракцией. При сорбции паров пористыми телами может происходить капиллярная конденсация. Обычно одновременно протекает несколько сорбционных процессов.
Адсорбция – изменение концентрации вещества на границе раздела фаз по сравнению с объемом. Различают два типа адсорбции. Хемосорбция – поглощение газов или растворенных веществ твердыми или жидкими поглотителями, сопровождающееся образованием химических соединений. Физическая адсорбция обусловлена силами межмолекулярного взаимодействия; она, как правило, является обратимой. Косвенным критерием определения типа адсорбции является значение теплоты адсорбции Q, то есть теплоты, выделяющейся в процессе адсорбции и отнесенной к одному молю адсорбата. Если Q < 30–40 кДж/моль, говорят о физической адсорбции, при Q > 40 кДж/моль – о хемосорбции. Концентрирование вещества в поверхностном слое идет самопроизвольно, процесс сорбции характеризуется отрицательным значением приращения потенциала Гиббса, при этом изменение энтропии при физической адсорбции всегда отрицательно, а при хемосорбции, в принципе, может быть и положительным. Поэтому энтальпия физической адсорбции всегда отрицательна, а при хемосорбции, в некоторых случаях, бывает и положительной величиной. Для более четкого разграничения типов адсорбции необходимо сравнивать ряд других физико-химических характеристик этих процессов, например, энергии активации и скорости сорбции и десорбции.
В настоящее время при описании адсорбции используют два основных подхода – метод абсолютных концентраций (или полного содержания) и метод избытков Гиббса. Выбор того или иного подхода при количественном описании адсорбции обусловлен природой изучаемой системы. При рассмотрении адсорбции на твердых адсорбентах обычно используют метод полного содержания, так как количество адсорбированного вещества можно определить экспериментально. Для жидкой поверхности раздела непосредственно измеряют межфазное поверхностное натяжение, и для расчета адсорбции используют метод избытков Гиббса.
Физическая адсорбция является обратимым процессом, условие равновесия которого определяется равными скоростями адсорбции молекул адсорбента P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P :
S* + P → S – P;
Уравнение равновесия в таком случае:
K = [S-P]/[S*][P],
где K – константа равновесия, [S – P] и [S*] – доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] – концентрация адсорбента.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
θ = αP/(1+αP),
где θ – доля площади поверхности адсорбента, занятая адсорбатом, α – адсорбционный коэффициент Ленгмюра, а P – концентрация адсорбента.
Абсорбция – процесс поглощения газа жидким поглотителем, в котором газ растворим в той или иной мере. Обратный процесс – выделение растворенного газа из раствора – называется десорбцией. На практике абсорбции подвергают не отдельные газы, а газовые смеси, составные части которых могут поглощаться данным поглотителем в заметных количествах. Во многих случаях поглотитель представляет собой раствор активного компонента, вступающего в химическую связь с абсорбируемым компонентом; при этом вещество, в котором растворено активное вещество, называется растворителем.
Ключевые слова
Разделы наук
Применение эффекта
Процесс сорбции применяется в следующих целях:
- Получение готового продукта путем поглощения газа жидкостью.
- Разделение газовых смесей для выделения одного или нескольких компонентов смеси. В этом случае применяемый поглотитель должен обладать как можно большей поглотительной способностью по отношению к извлекаемому компоненту и как можно меньшей к остальным составным частям газовой смеси.
- Очистка газов от примесей вредных компонентов. Такая очистка осуществляется прежде всего в целях удаления примесей, не допустимых при дальнейшей переработке газов.
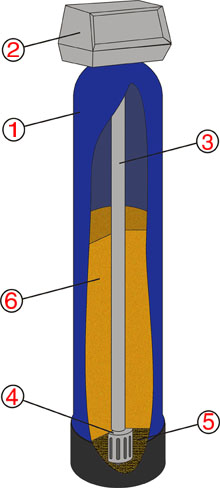
- Очистка жидкостей (рис. 1) при помощи фильтров. Основной принцип работы – пропускание жидкости сквозь фильтрующую среду, выбор которой во многом зависит от состояния исходной жидкости и расчетной степени очистки.
Схема фильтра для очистки воды
Рис. 1
1 – корпус фильтра, 2 – блок управление фильтром, 3 – центральный распределительный стояк, 4 – нижний распределитель, 5 – гравийная подложка, 6 – фильтрующая среда
Реализации эффекта
Процесс производства серной кислоты состоит из нескольких этапов. 1. Сжигание серы (S+O2=SO2). 2. Контактное окисление SO2 в SO3 (является примером гетерогенного окислительного экзотермического катализа SO2+0.5.O2=SO3). 3. Абсорбция триоксида серы из газовой смеси:
nSO3+H2O = H2SO4+(n-1)SO3+Q.
При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO2 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции.
Бензольные углеводороды, образующиеся при коксовании углей, находятся в коксовом газе в виде паров и улавливаются из газа различными способами.
1. Абсорбция бензольных углеводородов специальными поглотительными маслами при атмосферном или повышенном давлении коксового газа. В качестве поглотителей применяют каменноугольное масло, получаемое на коксохимических заводах при ректификации смолы, и соляровое масло, являющееся продуктом перегонки нефти. Улавливание бензольных углеводородов может осуществляться в скрубберах или в абсорберах тарельчатого типа.
Улавливание бензольных углеводородов из коксового газа поглотительными маслами при атмосферном давлении получило повсеместное применение в отечественной коксохимической промышленности.
2. Адсорбция бензольных, углеводородов твердыми поглотителями (активированным углем, кизельгуром или силикагелем), обладающими большой внутренней поверхностью пор. Например, 1 г активированного угля имеет от 200 до 1000 м2 активной поверхности, поверхность 1 г силикагеля достигает 450 м2.
Извлечение бензольных углеводородов из газа активированным углем практически полное, что позволило применить этот метод для лабораторного контроля, т.е. количественного определения бензола в газе.
Промышленное применение этого способа пока очень ограничено, главным образом из-за необходимости тщательной очистки газа от смолы, масел, сероводорода и других примесей и частично из-за высокой стоимости поглотителя.
3. «Вымораживание» бензольных углеводородов. Коксовый газ под давлением охлаждается в несколько ступеней до –45°С, при этом бензольные углеводороды конденсируются и удаляются из газа. Сырой бензол, получаемый этим методом, по своему качеству значительно чище и не содержит сольвет-нафты. Однако этот метод из-за сложности процесса и необходимости применять дорогую аппаратуру для охлаждения газа не получил распространения.
Литература
 1. Рамм В.М. Абсорбция газов. – М.: Химия, 1976.
1. Рамм В.М. Абсорбция газов. – М.: Химия, 1976.
 2. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
2. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.


![]() 1. Рамм В.М. Абсорбция газов. – М.: Химия, 1976.
1. Рамм В.М. Абсорбция газов. – М.: Химия, 1976.
![]() 2. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
2. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.