

|
|
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии | |
|
Стартовая страница |
О системе |
Технические требования |
Синтез |
Обучающий модуль |
Справка по системе |
Контакты |
| Пфунда серия | |
Описание
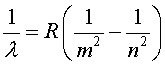
Где n - (главное квантовое число) - натуральное число большее 5. Все линии серии Пфунда расположены в далеком инфракрасном диапазоне.
Ключевые слова
Разделы наук
 Свойства ядер. Радиоактивность. Ядерные реакции
Свойства ядер. Радиоактивность. Ядерные реакции Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Излучение и детектирование света
Излучение и детектирование света Взаимодействие света с веществом
Взаимодействие света с веществом Квантовая механика
Квантовая механика
Применение эффекта
Исследование спектров началось в 1860 г., когда была опубликована работа немецких ученых Г. Кирхгофа и Р. Бунзена «Химический анализ с помощью наблюдений спектра». В после последующие годы изучение атомных спектров велось весьма интенсивно. Найденные в них закономерности позволили получить неоценимую информацию о внутренним устройстве атомов.
Каждый атом и молекула имеют уникальное строение, которому соответствует свой уникальный спектр. Структура спектра атома, молекулы или образованной ими макросистемы определяется их энергетическими уровнями. Согласно законам квантовой механики, каждый энергетический уровень соответствует определенному квантовому состоянию. Анализируя спектр конкретной системы, можно определить энергии и квантовые числа состояний, а также сделать выводы относительно действующих в ней сил. Таким образом, спектроскопия является основным источником сведений о квантово-механических величинах и о строении атомов и молекул.
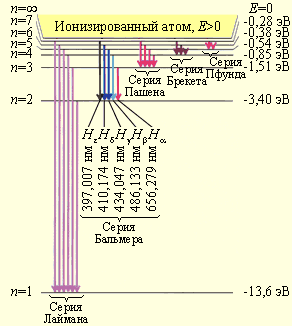
Изучение атомных спектров послужило ключом к познанию строения атомов. Прежде всего было замечено, что линии в спектрах атомов располагаются не беспорядочно, а объединяются в группы, или, как их называют, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома – водорода. Линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Спектральный анализ уже давно применяется в химии и материаловедении для определения следовых количеств элементов. Методы спектрального анализа стандартизованы, информация о характерных линиях большинства элементов и многих молекул хранится в компьютерных базах данных, что в значительной мере ускоряет анализ и идентификацию химических веществ.
Спектроскопия открыла широкие возможности для получения информации фундаментального характера во многих областях науки. Так, в астрономии собранные с помощью телескопов спектральные данные об атомах, ионах, радикалах и молекулах, находящихся в звездном веществе и межзвездном пространстве, способствовали углублению наших знаний о таких сложных космологических процессах, как образование звезд и эволюция Вселенной на ранней стадии развития.
В спектрах большинства астрономических объектов наблюдаются линии водорода, возникающие при переходе на первый энергетический уровень. Это серия Лаймана, наблюдаемая в ультрафиолете; отдельные линии серии имеют обозначения Lα (λ = 121,6 нм), Lβ (λ = 102,6 нм), Lγ (λ = 97,2 нм) и так далее. В видимой области спектра наблюдаются линии водорода серии Бальмера. Это линии Hα (λ = 656,3 нм) красного, Hβ (λ = 486,1 нм) голубого, Hγ (λ = 434,0 нм) синего и Hδ (λ = 410,2 нм) фиолетового цвета. Линии водорода наблюдаются и в инфракрасной части спектра – серии Пашена, Брэккета и Пфунда.
Реализации эффекта
.jpg)
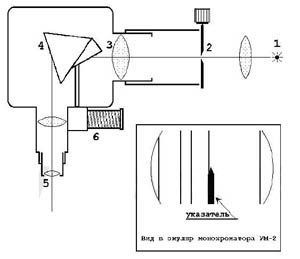
В качестве источника излучения может выступать водородная лампа. Она представляет собой две стеклянные трубки, соединенные капилляром диаметром в несколько миллиметров. В торцы трубок впаяны электроды. Лампа заполнена водородом при давлении 10 мм рт.ст. Тлеющий электрический разряд в водороде возникает между холодными электродами трубки через капилляр, что обеспечивает высокую плотность тока, и, следовательно, повышенную интенсивность свечения. Для изучения спектральной серии нужен спектральный прибор, позволяющий исследовать мало интенсивные источники излучения (линии) и обладающий достаточной дисперсией для наблюдения «далёких» линий серии. В данной установке в качестве спектрального прибора используется монохроматор УМ-2(рис.2).
В качестве приемника излучения вплоть до 1950-х годов широко применялись различные фотопластинки. Их чувствительность позволяла производить измерения во всем диапазоне длин волн от ближней ИК- (1,3 мкм) до вакуумной УФ-области (100 нм и менее). Позже на смену фотопластинкам пришли электронные детекторы и фотодиодные матрицы. В ИК-области традиционными радиометрическими детекторами были и остаются болометры, радиометры и термоэлементы. Затем появились различные типы малоинерционных и чувствительных фотоэлементов и фотосопротивлений. В видимой и УФ-областях спектра чрезвычайно чувствительны фотоумножители. Они малоинерционны, имеют малый темновой ток и низкий уровень шумов. Применяются также малоинерционные чувствительные многоканальные детекторы. К ним относятся фотодиодные матрицы с микроканальными пластинами и приборы с зарядовой связью. Как и фотопластины, многоканальные детекторы регистрируют сразу весь спектр одновременно; данные с них легко вводятся в компьютер.
Литература
![]() 1. Иродов И. Е. Квантовая физика. Основные законы: Учеб. пособие для вузов.– М.: Лаборатория Базовых Знаний, 2002
1. Иродов И. Е. Квантовая физика. Основные законы: Учеб. пособие для вузов.– М.: Лаборатория Базовых Знаний, 2002
![]() 2. Савельев И. В. Курс общей физики. Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц.
2. Савельев И. В. Курс общей физики. Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц.
![]() 3. Фриш С.Э. Оптические спектры атомов М.:1963
3. Фриш С.Э. Оптические спектры атомов М.:1963
| Стартовая страница О системе Технические требования Синтез Обучающий модуль Справка по системе Контакты | |
| Copyright © 2008 РГУ нефти и газа им. И.М. Губкина | |