|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Дюлонга-Пти закон |
 |
Зависимость теплоемкости твердых тел от количества вещества или равенств молярных теплоемкостей твердых тел
Описание
Твердое тело как микроскопический объект представляет собой в целом очень сложную систему, это N сильно взаимодействующих друг с другом атомов, образующих вместе единую связанную систему - гигантскую N - атомную молекулу с огромным числом внутренних степеней свободы, возбуждение которых и составляет основу теплового движения твердого тела. Будем полагать, что:
а) пространственная кристаллическая решетка совершенно правильная, без каких либо дефектов, а сам кристалл - одноатомный, т.е. в каждом узле решетки находится только один атом (без дополнительных внутренних степеней свободы);
б) ограничимся только гармоническим приближением, т.е. случаем малых колебаний пространственной решетки, заполненной по узлам точечными массами. С точки зрения механики движения такой N - атомной молекулы, представляющей собой 3N связанных осцилляторов, может быть приведено к 3N нормальным колебаниям, т.е. не зависящим друг от друга гармоническим колебаниям с разными собственными частотами, образующими набор значений {ω}. При этом каждое нормальное колебание представляет собой суперпозицию смещений сразу очень большого числа узлов решетки, это характерный коллективный эффект сразу для всего кристалла. в целом. Так как все собственные колебания считаются независимыми друг от друга, то микроскопическое значение энергии системы равно сумме слагаемых :
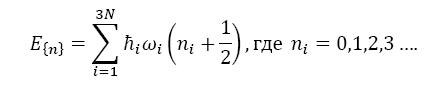
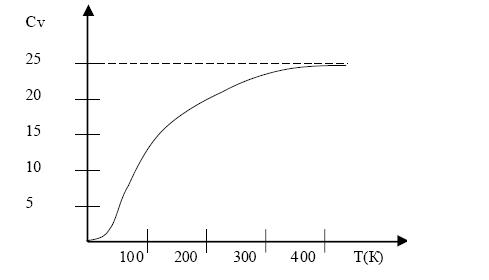
В 1818 г. П.Дюлонг и А.Пти (P.Dulong and A.Petit) экспериментально установили закон, согласно которому теплоемкость СV всех твердых тел при достаточно высокой температуре есть величина постоянная , не зависящая от температуры и составляющая около 3R 25 Дж/( моль К) – значение Дюлога–Пти, т.е. при нагревании любого вещества на 1К каждый атом поглощает одинаковое количество энергии 3kB . В классической модели твердого тела это объясняется как сумма кинетической энергии, по kBТ/2 на каждую степень свободы (равнораспределение), и потенциальной энергии, равной кинетической. Т.е. энергия 1 моля вещества – U = 3NakBT, а его теплоемкость – СV = ( U/ T)V = 3NakB = 3R, в полном соответствии с законом Дюлонга–Пти. Однако, приведенное согласие нарушается, если учесть, что в кристалле кроме атомов имеются квазисвободные электроны проводимости, которые согласно классической статистике, так же как и атомы, должны обладать кинетической энергией по kBТ/2 на каждую из 3–х степеней свободы, т.е. полная энергия, и соответственно, теплоемкость одновалентного металла в 1.5 раза больше, чем значение Дюлонга–Пти, а именно, СV = (9/2)R. Т.о. в рамках классического подхода остается необъяснимым, почему электроны не дают вклад в теплоемкость? Второй принципиальный вопрос, на который классический подход не дает правильного ответа – вопрос о температурной зависимости теплоемкости. В отличие от классического предсказания, экспериментальные данные свидетельствуют о том, что СV=const. Эти проблемы решены в квантовой теории динамики решетки.
Зависимость теплоемкости от температуры
Рис.1
Ключевые слова
Разделы наук
Применение эффекта
В 1819 г. Дюлонг, совместно с А.Т. Пти, установил закон теплоёмкости твёрдых тел, согласно которому произведение удельных теплоёмкостей простых твёрдых тел на атомную массу образующих элементов есть величина приблизительно постоянная (в современных единицах измерения равная примерно 25 Дж/(г•К); ныне это соотношение носит название "закон Дюлонга – Пти". Закон удельной теплоёмкости, довольно долгое время остававшийся незамеченным современниками, послужил впоследствии основой метода приближённой оценки атомных масс тяжёлых элементов. В 1818 г. Дюлонг и Пти вывели также общую формулу для скорости охлаждения твёрдых тел. Метод, основанный на законе Дюлонга и Пти, согласно которому атомная теплоёмкость простого вещества в твёрдом состоянии (т. е. произведение его удельной теплоёмкости на молярную массу атомов) есть величина постоянная и равная в среднем 26 Дж/((К ·моль). Из закона Дюлонга и Пти следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определяемую экспериментально, можно найти приблизительное значение атомной массы данного элемента.
Техническая реализация - закон теплоемкости Дебая учитывают при проведении теплофизических криогенных расчетов в случае низких температур, например при расчете магнитно - калорического эффекта, используемого как способ достижения особо низких температур (менее 1 К). Такое охлаждение оказывается особо эффективным, поскольку согласно закону теплоемкости Дебая, теплоемкость всех твердых тел вблизи Т =0 К сильно (как Т 3) убывает при уменьшении Т. Для охлаждения до сверхнизких температур используют изотермическое намагничивание - адиабатическое размагничивание парамагнитной соли. Закон теплоемкости Дебая используют для оценочных расчетов теплоемкости, теплопроводности, электропроводности веществ, рассеяния излучений веществами при низких температурах порядка 0 - 100 К. Для проведения таких расчетов для каждого вещества подобрана по сопоставлению с экспериментальными данными своя температура Дебая, она обычно приводится в справочниках.
Закон теплоемкости Дебая используют для технических расчетов в криогенной технике (устройств для хранения и транспортировки сжиженных газов, устройств для охлаждения до низких температур). Из закона теплоемкости Дебая следует, что при низких температурах теплоемкость мала, поэтому малые количества тепла, сообщенные системе, приводят к большим изменениям температуры входящих в систему тел. Из-за этого в системе возникают большие температурные напряжения, которые надо учитывать при проектировании технических систем.
Реализации эффекта
Многие физические системы можно смоделировать в виде системы связанных гармонических осцилляторов. Движения таких осцилляторов можно разложить на нормальные моды, которые можно представить как вибрационные моды струны фортепьяно или резонансы трубы органа. С другой стороны, теорема о равнораспределении становится неприменимой для таких систем из-за отсутствия обмена энергии между нормальными модами. В предельном случае моды независимы и, таким образом, их энергии сохраняются независимо. Это означает, что смешивание энергий, формально называемое эргодичностью, важно для выполнения закона равнораспределения.
Самое просто предположение о колебательном движении узлов кристаллической решетки - это положить, что все они колеблются с одинаковой частотой, т.е. спектральная плотность собственных частот представляет собой сосредоточенный единичный пик в области некоторой частоты ωE: dГ(ω)=3Nδ(ω-ωE)dω. Внутренняя энергия такой системы представляет собой 3N - кратный осцилятор, равна:
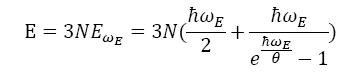
При высоких температурах θ>>ℏωE, выход удельной теплоемкости c=C/N=3∂EωE/∂θ на константу, равную c∞=3, можно с достаточно хорошим совпадением с экспериментальными данными описать, подбирая параметр ωE. Однако, при θ<<ℏωE - ничего общего с экспериментом, кроме тенденции с→0, при θ→0. Наблюдается степенная зависимость:
П.Дебай предположил, что в кристалле существует три типа акустических волн: 2 поперечные и одна продольная. В этом случае средняя энергия будет равна:
Где (y) - введенная константа, зависит от поляризации волны и может принимать значение 2 или 3. Теплоемкость в этом случае будет выражена:
Литература
 1. И.А. Квасников Статистическая физика, издание 2, стр 192
1. И.А. Квасников Статистическая физика, издание 2, стр 192
 2. Л.Д. Ландау, Е.М. Лифшиц том 5, Статистическая физика, издание 3, стр 213
2. Л.Д. Ландау, Е.М. Лифшиц том 5, Статистическая физика, издание 3, стр 213
 3. О.Маделунг Теория твердого тела, Наука 1980, стр 141
3. О.Маделунг Теория твердого тела, Наука 1980, стр 141
 4. Сивухин Д. В. Общий курс физики Т. II. Термодинамика и молекулярная физика.
4. Сивухин Д. В. Общий курс физики Т. II. Термодинамика и молекулярная физика.
 5. И. В. Савельев, Курс общей физики, том 1.
5. И. В. Савельев, Курс общей физики, том 1.
 6. Большой энциклопедический словарь/ Гл. ред. А.М. Прохоров. Ред. кол: Д.М. Алексеев, А.М. Бонч–Бруевич, А.С. Боровик–Романов и др.–М.: 7. Большая Российская энциклопедия. 1999. Стр. 186.
6. Большой энциклопедический словарь/ Гл. ред. А.М. Прохоров. Ред. кол: Д.М. Алексеев, А.М. Бонч–Бруевич, А.С. Боровик–Романов и др.–М.: 7. Большая Российская энциклопедия. 1999. Стр. 186.


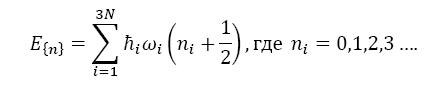
 Физико-химические явления
Физико-химические явления Механические свойства твердых тел
Механические свойства твердых тел Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Твердые тела
Твердые тела Квантовая механика
Квантовая механика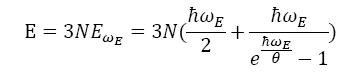
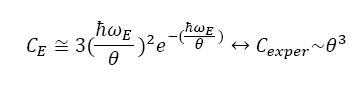
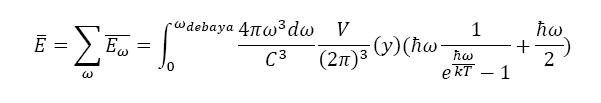
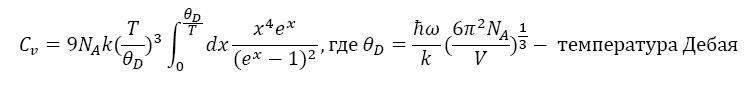
![]() 1. И.А. Квасников Статистическая физика, издание 2, стр 192
1. И.А. Квасников Статистическая физика, издание 2, стр 192
![]() 2. Л.Д. Ландау, Е.М. Лифшиц том 5, Статистическая физика, издание 3, стр 213
2. Л.Д. Ландау, Е.М. Лифшиц том 5, Статистическая физика, издание 3, стр 213
![]() 3. О.Маделунг Теория твердого тела, Наука 1980, стр 141
3. О.Маделунг Теория твердого тела, Наука 1980, стр 141
![]() 4. Сивухин Д. В. Общий курс физики Т. II. Термодинамика и молекулярная физика.
4. Сивухин Д. В. Общий курс физики Т. II. Термодинамика и молекулярная физика.
![]() 5. И. В. Савельев, Курс общей физики, том 1.
5. И. В. Савельев, Курс общей физики, том 1.
![]() 6. Большой энциклопедический словарь/ Гл. ред. А.М. Прохоров. Ред. кол: Д.М. Алексеев, А.М. Бонч–Бруевич, А.С. Боровик–Романов и др.–М.: 7. Большая Российская энциклопедия. 1999. Стр. 186.
6. Большой энциклопедический словарь/ Гл. ред. А.М. Прохоров. Ред. кол: Д.М. Алексеев, А.М. Бонч–Бруевич, А.С. Боровик–Романов и др.–М.: 7. Большая Российская энциклопедия. 1999. Стр. 186.