|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Десорбция |
 |
Зависимость скорости выхода из вещества поглощенных молекул от температуры
Описание
Десорбция (от лат. sorbeo – поглощаю), удаление из жидкостей или твердых тел веществ, поглощённых при адсорбции или абсорбции. Применяется при регенерации адсорбентов и абсорбентов путём нагревания, понижения давления, продувки несорбируемыми газами или парами, обработки растворителями. В связи с этим существует достаточно большое количество типов десорбции.
Десорбция является процессом, обратным адсорбции, то есть процессом переноса вещества с поверхности раздела фаз в объем фазы.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
S* + P⇔ S-P;
уравнение равновесия в таком случае:
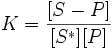
,
где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
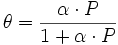
,
где θ — доля площади поверхности адсорбента, занятая адсорбатом, α — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Рассмотрим принципы "мягкой" десорбции, которая широко применяется в различных десорбционных методах ионизации вещества.
Основной принцип «мягкой» десорбции можно представить следующим образом. Если соединение АВ, находящееся в конденсированном состоянии, подвергается нагреву, то переход его в газовую фазу может происходить как с разложением на фрагменты А и B, так и с испарением в виде целой молекулы AB:
AB → A+B (процесс разложения);
AB→ AB (процесс испарения).
Константы скорости таких процессов в простейшем приближении можно описать уравнением Аррениуса и записать в следующем виде:
где Fv и Fd — предэкспоненциальные множители; Ed и Ev — энергии активации для процессов разложения и испарения, соответственно, R — газовая постоянная и T — абсолютная температура.
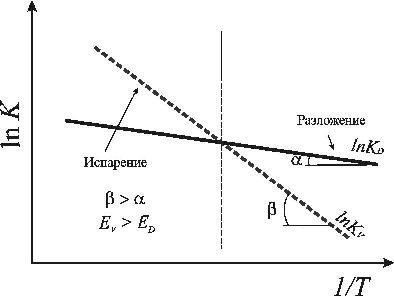
На рис.1 схематично приведены зависимости констант скорости процессов испарения и разложения от температуры. Условием для распада термически неустойчивых соединений при испарении будет превалирование константы скорости разложения Kd над константой скорости испарения Kv. Из-за того, что величина энергии активации испарения Ev выше, чем энергия активации разложения Ed, угол наклона прямой, отвечающей процессу испарения lnKv, больше, чем для процесса разложения lnKd относительно оси абсцисс 1 / T. Таким образом, при низких температурах (в правой части графика) будет преобладать разложение вещества АВ, однако с увеличением температуры может быть достигнуто условие, при котором скорость процесса испарения будет существенно преобладать над разложением (левая часть графика). Иными словами, мгновенное достижение высокой температуры может привести к тому, что молекулы AB смогут испаряться без разложения.
Зависимости констант скорости процессов испарения и разложения от температуры
Рис.1
Ключевые слова
Разделы наук
Применение эффекта
В течение последних двух-трех десятилетий значительное внимание уделялось созданию принципиально новых методов получения в газовой фазе ионов соединений, ограниченная летучесть (или полное ее отсутствие) которых не позволяет воспользоваться традиционными подходами. К таким классам относятся различные высокомолекулярные молекулы, биоорганические объекты, всевозможные термолабильные органические и металлоорганические соединения. Реальным прорывом в этой области послужило появление методов ионизации, при которых десорбция и ионизация вещества осуществляется путем бомбардировки (облучения) их ионами, фотонами или нейтральными частицами.
В конце 1970-х гг. Макфарлейном (англ. Macfarlane) и сотр. был разработан метод ионизации биомолекул быстрыми продуктами деления 252 Cf — метод плазменной десорбции (ПД). Тогда впервые была показана возможность масс-спектрометрии в определении точных молекулярных масс для нелетучих соединений, ранее недоступных для анализа методами электронной и химической ионизации. Чуть позднее Беннингховен (англ. Benninghoven) и сотр. стали использовать для бомбардировки ионы Ar+, что послужило началом развития метода ВИМС. В начале 1980-х гг. в работах Барбера (англ. Barber) и сотр. был представлен метод ББА инертного газа . В это же время Сурман (англ. Surman) и Викерман (англ. Vickerman) выдвинули идею использования жидкой матрицы, которая впоследствии явилась основой для методики анализа различных сложных органических соединений. Так, уже к началу 1980-х гг. было показано, что с помощью метода ББА в жидкой матрице в сочетании с масс анализатором с секторным магнитным полем можно изучать молекулы с массами до 20 кДа.
В середине 1980-х гг. были предложены различные идеи использования матрицы, когда десорбция/ионизация вещества индуцировалась импульсным лазерным излучением. В 1985 г. методика на основе использования мелкодисперсного порошка кобальта для поглощения излучения лазера в глицериновом растворе была предложена Танаке (англ. Tanaka). Благодаря этой методике были впервые получены молекулярные ионы с массами более чем в 100 кДа. В 2002 г. Койчи Танака, наряду с Джоном Феном ( метод ионизации при электрораспылении), была присуждена Нобелевская премия за вклад в развитие «методов мягкой десорбционной ионизации для масс-спектрального анализа биологических макромолекул» .
Карас (англ. Karas) и Гилленкамп (англ. Hillenkamp) предложили применять в качестве матрицы молекулы органических веществ небольших размеров, обладающие высокими абсорбционными свойствами при длине волны лазерного излучения. Это легло в основу метода МАЛДИ. Метод МАЛДИ открыл более широкие возможности масс-спектрометрии в исследовании таких биомолекул, как пептиды, белки, олигонуклеотиды, полисахариды и др. Диапазон масс молекул, которые можно изучать этим методом, практически неограничен: известны случаи, когда в спектрах наблюдали ионы с массами более чем 1000 кДа.
К настоящему времени МАЛДИ масс-спектрометрия существенно потеснила все остальные десорбционные методы. Современные масс спектрометры МАЛДИ являются более коммерчески доступными и встречаются в очень большом числе лабораторий всего мира. Во многом благодаря своей универсальности и простоте в выполнении экспериментов МАЛДИ остается одним из самых популярных методов аналитической масс-спектрометрии для анализа крупных органических молекул.
Реализации эффекта
Биогаз - газовая смесь, образующаяся в результате анаэробного сбраживания органических отходов в присутствии метанообразующих бактерий. Основными источниками биогаза являются свалки и полигоны бытовых отходов, очистные сооружения, отходы сельского хозяйства и промышленности, содержащие органику. Выделение биогаза зависит от многих параметров: влажности, температуры, состава отходов, кислотности и т.д. Метанообразующие микроорганизмы появляются в отходах при водосодержании > 50%, температуре > 30°С, значении рН > 7. Состав биогаза зависит от состава отходов и представляет собой газовую смесь метана (50-70%) и диоксида углерода. В зависимости от исходного сырья биогаз может содержать сероводород, азот, кислород, аммиак, водород, пары воды и другие примеси в незначительных количествах. Биогаз является горючей смесью, однако его теплотворная способность значительно (примерно на 50%) снижена из-за присутствия в его составе диоксида углерода, который является в нем ненужным балластом. Отрицательное влияние оказывает также наличие в составе биогаза сероводорода и паров воды, что может привести к образованию сернистой кислоты, вызывающей коррозию металлического оборудования. Сейчас биогаз в основном используется в виде энергетического топлива для сжигания в тепловых котлах и различных двигателях-генераторах. Если биогаз не используется, то его факельно сжигают для предотвращения эмиссии метана в атмосферу. Эффективность использования биогаза в значительной степени зависит от его качества. Если повысить содержание метана в биогазе до 90%, то его можно использовать в качестве топлива для двигателей, работающих на метане. Увеличив содержание метана в биогазе до 96%, т.е. доведя его до качества природного газа, можно использовать биогаз вместо метана в различных технологических процессах. Существует много способов повышения качества биогаза путем снижения содержания примесей в нем. Основными из них являются адсорбционный, абсорбционный, криогенный, мембранный и некоторые другие.
Использование адсорбционных процессов для повышения качества биогаза реализуется главным образом в виде адсорбционных установок периодического действия. Установки, применяемые для поглощения примесей из потока биогаза, обычно имеют две параллельные газовые линии, одна из которых находится в стадии адсорбции, а вторая - в стадии десорбции. После насыщения примесными компонентами первой линии, в стадию адсорбции включается вторая линия, а первая переходит в стадию десорбции. Продолжительность цикла может быть от нескольких секунд до нескольких десятков часов, в зависимости от производительности и конструкции адсорбционной установки.
Основные энергозатраты при работе адсорбционной установки - это затраты на десорбцию примесных компонент с адсорбента. Пары воды и сульфид водорода при комнатной температуре десорбируются с цеолитов очень плохо за счет высокой теплоты адсорбции (десорбции), поэтому их десорбцию осуществляют при повышенных температурах (до 350°С) продувкой горячего воздуха или понижением давления над адсорбентом. Величина десорбируемого с цеолитов при комнатной температуре диоксида углерода довольно большая, поэтому его десорбцию можно осуществлять при комнатной температуре. Это особенно важно для работы короткоцикловых адсорбционных установок. Зависимость величины десорбции диоксида углерода от времени для различных цеолитов при форвакуумной откачке и комнатной температуре изображена на рис. 1.
Зависимость величины относительной десорбции диоксида углерода с различных адсорбентов от времени десорбции при температуре 20°С и давлении 1 Па
Рис.1
Из рис. 1 видно, что наибольшая величина десорбции наблюдается для цеолита СаА. Учитывая то, что цеолит СаА имеет наибольшие среди исследованных цеолитов величины адсорбции и десорбции при комнатной температуре, можно сделать вывод, что цеолит СаА является наиболее эффективным адсорбентом для очистки биогаза от диоксида углерода.
При вытеснительной хроматографии десорбция осуществляется промывкой адсорбционной колонки каким-либо органическим растворителем, адсорбционная способность которого значительно выше, чем у любого компонента исследуемой смеси. В качестве таких вытеснителей применяют спирты, кетоны, эфиры, хлорорганические растворители, бензол, толуол и др. Возможно и последовательное применение различных десорбентов, особенно при хроматографировании высокомолекулярных продуктов. Так как проявитель (вытеснитель) обладает большой адсорбционной способностью, то он вытесняет с поверхности адсорбента последовательно все компоненты исследуемой смеси в порядке, обратном их энергии адсорбции.
Парообразная смесь поступает в реакторный блок, который состоит из трех адсорберов, работающих по сменно-циклическому графику. Схема работы адсорберов следующая: в течение первого периода протекает стадия адсорбции, затем адсорбер переключается на стадию продувки и, наконец, в нем проводится стадия десорбции. Десорбция осуществляется с помощью вытесняющего средства – аммиака. С низа перколятора отработанный адсорбент через стояк поступает в промывную колонну, в которой частичная десорбция осуществляется нагретым растворителем. Чтобы раствор исходного сырья не попадал в промывную колонну, в нижнюю часть перколятора и стояк подается растворитель.
Литература
 1. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 296с. с.123
1. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 296с. с.123
 2. Хамаев В.Х. Химия углеводородов нефти и газа, 1990, 147с. с.28.
2. Хамаев В.Х. Химия углеводородов нефти и газа, 1990, 147с. с.28.
 3. Эрих В.Н. Химия и технология нефти и газа, 1977, 424 с. с.58, с.316
3. Эрих В.Н. Химия и технология нефти и газа, 1977, 424 с. с.58, с.316
 4. Еловиков С.С.// Разрушение поверхности твердого тела медленными электронами,1999,No10,с.100–107.
4. Еловиков С.С.// Разрушение поверхности твердого тела медленными электронами,1999,No10,с.100–107.


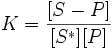 ,
,
 Физико-химические явления
Физико-химические явления Взаимодействие потоков частиц с веществом
Взаимодействие потоков частиц с веществом Фазовые переходы
Фазовые переходы Жидкости
Жидкости Твердые тела
Твердые тела Реальные газы
Реальные газы Явления переноса
Явления переноса Термодинамика
Термодинамика Дозвуковые течения жидкости и газа в отсутствии незакрепленных обтекаемых тел
Дозвуковые течения жидкости и газа в отсутствии незакрепленных обтекаемых тел Общие вопросы газо- и гидродинамики
Общие вопросы газо- и гидродинамики Динамика
Динамика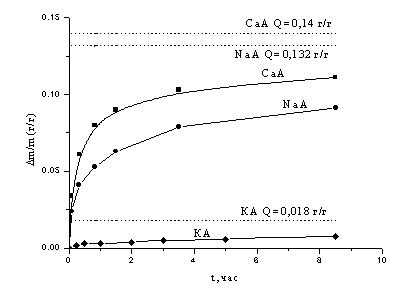
![]() 1. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 296с. с.123
1. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 296с. с.123
![]() 2. Хамаев В.Х. Химия углеводородов нефти и газа, 1990, 147с. с.28.
2. Хамаев В.Х. Химия углеводородов нефти и газа, 1990, 147с. с.28.
![]() 3. Эрих В.Н. Химия и технология нефти и газа, 1977, 424 с. с.58, с.316
3. Эрих В.Н. Химия и технология нефти и газа, 1977, 424 с. с.58, с.316
![]() 4. Еловиков С.С.// Разрушение поверхности твердого тела медленными электронами,1999,No10,с.100–107.
4. Еловиков С.С.// Разрушение поверхности твердого тела медленными электронами,1999,No10,с.100–107.