|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Ленгмюра уравнение для испарения, адсорбции |
 |
Зависимость заполнения поверхности адсорбента от концентрации газа в объеме
Анимация
Описание
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется. Теория Ленгмюра и следующее из неё уравнение Ленгмюра являются одной из наиболее распространенных теорий мономолекулярной адсорбции.
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием так называемых свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; таким образом, через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров х, а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата С на долю свободных активных центров 1 – х:
Отсюда находим х:
Разделив числитель и знаменатель правой части уравнения на kA, получим:
Максимально возможная величина адсорбции Го достигается при условии, что все активные центры заняты молекулами адсорбата, то есть х = 1. Отсюда следует, что х = Г / Го. Подставив это в уравнение, получаем:
Это уравнение есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рисунке 1. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
Изотерма мономолекулярной адсорбции
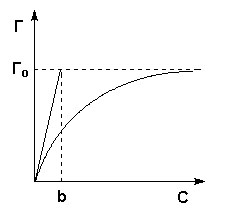
Рис.1
При описании процесса адсорбции газов концентрация может быть заменена пропорциональной величиной парциального давления газа:
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Ключевые слова
Разделы наук
Применение эффекта
Уравнение Ленгмюра можно использовать только при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это условие выполняется достаточно строго при хемосорбции, физической адсорбции газов при небольших давлениях и температурах выше критической (в отсутствие конденсации на поверхности адсорбента), а также при адсорбции из растворов. Указанное ограничение для применения уравнения Ленгмюра связано не столько с формальным описанием адсорбции, сколько с невозможностью получить правильные значения параметров уравнения, соответствующих их физическому смыслу.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и влияние поверхностных сил может распространяться па второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда газы и пары адсорбируются при температурах ниже критической. В этом случае образуются полимолекулярные слои вещества на поверхности адсорбента.
При адсорбции из водных растворов уравнение Ленгмюра наиболее пригодно в тех случаях, когда адсорбируются большие молекулы, например, молекулы гумусовых веществ, обусловливающие окраску природных вод .
Как видно из теории Ленгмюра, количество адсорбировавшихся молекул зависит от количества активных центров на поверхности твёрдого тела. Следовательно по количеству молекул можно судить о качестве поверхности адсорбента. Количество прореагировавшего адсорбата обычно определяют методами оценки коэффициента поверхностного натяжения.
Реализации эффекта
Все рассмотренные до сих пор уравнения справедливы для мономолекулярной адсорбции, протекающей на адсорбенте с энергетически эквивалентными адсорбционными центрами. Однако реальные поверхности твердых тел, как правило, не обладают такими свойствами. Для приближения к реальным условиям целесообразно рассмотрение возможных распределений адсорбционных центров поверхности адсорбента по энергиям. Приняв линейное распределение адсорбционных центров по энергиям (теплота адсорбции линейно зависит от заполнения поверхности х), М. И. Темкин, используя уравнение Ленгмюра, получил следующее уравнение для средних степеней заполнения адсорбента:
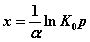
,
где α-постоянная характеризующая линейное распределение, К0 - константа отвечающая максимальной тепоте адсорбции.
Это уравнение обычно называют логарифмической изотремой адсорбции.
Литература
 1.Баландин А.А. Катализ Физико-химия гетерогенного катализа, 1967, 480 с. с.132, с.189.
1.Баландин А.А. Катализ Физико-химия гетерогенного катализа, 1967, 480 с. с.132, с.189.
 2.Воюцкий С.С. Курс коллоидной химии, 1976, 512 с.с.443.
2.Воюцкий С.С. Курс коллоидной химии, 1976, 512 с.с.443.
 3.Яворский Б.М., Селезнев Ю.А. Справочное руководство по физике. – 4-е изд., испр. - М.: Наука, 1989.-576с. Стр.287.
3.Яворский Б.М., Селезнев Ю.А. Справочное руководство по физике. – 4-е изд., испр. - М.: Наука, 1989.-576с. Стр.287.
 4.Ю.Г.Фролов. Курс коллоидной химии:поверхностные явления и дисперсные системы.1989.
4.Ю.Г.Фролов. Курс коллоидной химии:поверхностные явления и дисперсные системы.1989.


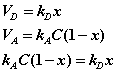
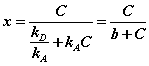

![]() 1.Баландин А.А. Катализ Физико-химия гетерогенного катализа, 1967, 480 с. с.132, с.189.
1.Баландин А.А. Катализ Физико-химия гетерогенного катализа, 1967, 480 с. с.132, с.189.
![]() 2.Воюцкий С.С. Курс коллоидной химии, 1976, 512 с.с.443.
2.Воюцкий С.С. Курс коллоидной химии, 1976, 512 с.с.443.
![]() 3.Яворский Б.М., Селезнев Ю.А. Справочное руководство по физике. – 4-е изд., испр. - М.: Наука, 1989.-576с. Стр.287.
3.Яворский Б.М., Селезнев Ю.А. Справочное руководство по физике. – 4-е изд., испр. - М.: Наука, 1989.-576с. Стр.287.
![]() 4.Ю.Г.Фролов. Курс коллоидной химии:поверхностные явления и дисперсные системы.1989.
4.Ю.Г.Фролов. Курс коллоидной химии:поверхностные явления и дисперсные системы.1989.