|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
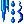 | Клапейрона-Клазиуса уравнение |
 |
Клапейрона-Клазиуса уравнение
Анимация
Описание
Клапейрона-Клаузиуса уравнение - термодинамическое уравнение, относящееся к процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.).
Для описания фазового перехода первого рода необходимо определить зависимость давления от температуры в точках фазового перехода: P = P(T), то есть форму кривой равновесия двух фаз. Применение методов равновесной термодинамики позволяет определить первую производную этой зависимости, или наклон кривой равновесия.
Предположим, что при подводе к одной из фаз двухфазной среды некоторого количества теплоты Q1, происходит переход части вещества, массой M, из первой фазы во вторую. Так как рассматриваемый переход считается квазиравновесным, то давление и температура при его осуществлении постоянны: P = const и T = const. Удельный объем, определяемый как отношение объема фазы к её массе для первой фазы равен v1, а для второе – соответственно v2. Количество вещества массой M занимает в первой фазе объем V1 = v1M, а во второй – объем V2 = v2M.
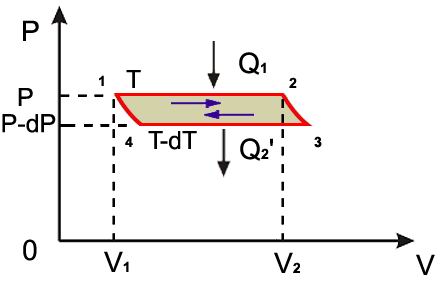
Переход вещества из первой фазы во вторую изображен на рисунке 1 как участок 1–2 некоторого кругового процесса, с помощью которого количество вещества массой M возвращается в исходное состояние в первой фазе. Будем считать, что этот круговой процесс представляет собой цикл Карно. Тогда процессы 2–3 и 4–1 являются адиабатическими, а изотермический процесс 3–4 описывает теплоотдачу при переходе вещества из второй фазы в первую. Считаем, что процесс 3–4 осуществляется при давлении P – dP и температуре T – dT, значения которых бесконечно близки к значениям давления P и температуры T протекания процесса 1–2.
Диаграмма к расчету фазового перехода первого рода
Рис. 1
На основании первой теоремы Карно можно записать выражение для к.п.д. рассматриваемого цикла:
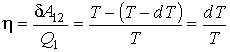
(1)
где δA12– совершаемая за цикл работа. С учетом бесконечной малости величины dP в первом приближении можно считать, что работа δA12, совершаемая за цикл Карно близка к работе цикла, представляющего собой прямоугольник бесконечно малой высоты. Это позволяет заменить адиабаты на боковых сторонах цикла Карно вертикальными отрезками при V = const, то есть представить цикл Карно в виде прямоугольника, высота которого равна бесконечно малой величине dP. В этом приближении имеем:
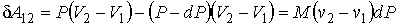
(2)
Фазовые переходы первого рода количественно характеризуются величиной удельной теплоты фазового перехода, которая численно равна количеству теплоты сообщаемой единице массы вещества для осуществления фазового перехода:
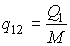
(3)
Тогда с учетом формул (2) и (3) выражение (1) можно преобразовать к виду:

(4)
Или:
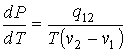
(5)
Это выражение называется
уравнением Клапейрона–Клаузиуса. Оно позволяет определить производную давления от температуры при равновесном
фазовом переходе первого рода в зависимости от
удельной теплоты перехода, его температуры и удельных объемов начальной и конечной фаз.
Уравнение Клапейрона–Клаузиуса можно получить также с помощью
удельного термодинамического потенциала. Для этого вычислим полные дифференциалы от правой и левой частей выражения
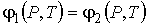
:
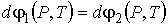
(6)
или
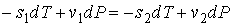
(7)
где: s1 и s2 – удельные энтропии первой и второй фаз соответственно.
Из выражения (7) имеем:
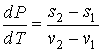
(8)
Так как процесс перехода вещества из одной фазы в другую считается равновесным и происходящим при постоянной температуре, то разность удельных энтропий этих фаз можно определить следующим образом:
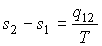
(9)
Подстановка этого выражения в формулу (8) приводит её к виду уравнения Клапейрона–Клаузиуса (5).
В соответствии с уравнением Клапейрона–Клаузиуса знак производной dP/dT зависит от соотношения удельных объем фаз. Если при подводе теплоты жидкость переходит в газообразное состояние, что сопровождается увеличением удельного объема: v2>v1, то производная dP/dT>0. Поэтому при таком переходе повышение давления приводит к увеличению температуры кипения. Аналогичная зависимость наблюдается и при плавлении большинства твердых тел. Исключение составляют вещества, для которых плавление сопровождается уменьшением их удельного объема: v2<v1. Примером такого вещества является вода, которая при переходе из замерзшего состояния в жидкое уменьшает свой удельный объем (плотность воды больше плотности льда). Для таких веществ характерно понижение температуры плавления при повышении давления.
Ключевые слова
Разделы наук
Применение эффекта
Уранение Клапейрона-Клаузиуса обычно применяется в химии и химический промышленности.
Это уравнение применительно к границе жидкость-пар может быть записано в форме:
где
T1 и P1 - температура (в Кельвинах) и давление пара соответственно,
T2 and P2 температура и давление в любой другой точке,
ΔHvap - молярная энтальпия испарения,
R - универсальная газовая постоянная (8.314 Дж моль-1K-1)
Это уравнение может быть использовано для предсказания температуры при конкретном давлении, зная температуру при другом давлении и наоборот. Кроме того, если известно давление и температура в каких-то двух точках, то можно определить энтальпию испарения.
Другую альтернативную формулировку уравнения Клапейрона-Клаузиуса можно дать, если сгруппировать одну из точек P,T в константу интегрирования
Например, если известны величины последовательности точек P,T вдоль фазовой границы, энтальпия может быть определена графически из зависимости lnP от 1/T.
Эквивалентное выражение закона Клапейрона-Клаузиуса для случая границы двердое тело-газ получается заменой молярной энтальпии испарения на молярную энтальпию сублимации, ΔHsub
При нормальных условиях уравнение Клапейрона-Клаузиуса принимает вид:
где:
es - давление насыщенного водяного пара,
T - температура,
Lv - скрытая теплота испарения,
Rv - газовая постоянная для водяного пара.
Еще один пример использования уравнения Клапейрона-Клаузиуса - определение возможности фазового перехода при данных условиях. Рассмотрим для примера задачу об определении давления, которое нужно приложить, чтобы растопить лед при температуре ΔT ниже 0 °C.
Примем
подставляя
L = 3.34×105 Дж/кг (теплота испарения воды),
T = 273 K (температура), и
ΔV = -9.05×10-5 м³/кг (изменение объема при переходе твердое тело-жидкость),
получим
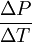
= -13.1 MПa/°C.
Расчет давлений насыщенных паров. Экспериментальные значения давлений насыщенных паров обычно описываются эмпирическими уравнениями, форма которых основывается на известном соотношении Клапейрона-Клаузиуса, обеспечивающем хорошее приближение зависимости Р = 2/3 (Т) при не очень больших давлениях.
Для определения теплоты парообразования по уравнению Клапейрона–Клаузиуса необходимо дополнительно располагать уравнениями для плотности или удельного объема жидкости на линии насыщения левой пограничной кривой и зависимостью давления насыщения от температуры. Аналитическая зависимость давления насыщения от температуры обычно задается уравнением вида ln р ~ f (Т).
Реализации эффекта
Согласно Клапейрона-Клаузиуса уравнение, теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесно протекающем процессе определяется выражением:
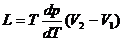
(1)
где Т – температура перехода (процесс изотермический), dp/dT – значение производной от давления по температуре при данной температуре перехода, (V2–V1) – изменение объёма вещества при переходе его из первой фазы во вторую.
Первоначально уравнение было получено в 1834 Б.П.Э. Клапейроном из анализа Карно цикла для конденсирующегося пара, находящегося в тепловом равновесии с жидкостью. В 1850 P. Клаузиус усовершенствовал уравнение и распространил его на другие фазовые переходы. Клапейрона-Клаузиуса уравнение применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т. н. фазовым переходом 1 рода), и является прямым следствием условий фазового равновесия, из которых оно и выводится.
Клапейрона-Клаузиуса уравнение может служить для расчёта любой из величин, входящих в уравнение, если остальные известны. В частности, с его помощью рассчитывают теплоты испарения, экспериментальное определение которых сопряжено со значительными трудностями.
Часто Клапейрона-Клаузиуса уравнение записывают относительно производных dp/dT или dT/dp:
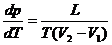
(2)
Для процессов испарения и сублимации dp/dT выражает изменение давления насыщенного пара р с температурой Т, а для процессов плавления и полиморфного превращения dT/dp определяет изменение температуры перехода с давлением. Иными словами, Клапейрона-Клаузиуса уравнение является дифференциальным уравнением кривой фазового равновесия в переменных р, Т.
Для решения Клапейрона-Клаузиуса уравнение необходимо знать, как изменяются с температурой и давлением величины L, V1 и V2, что представляет сложную задачу. Обычно эту зависимость устанавливают эмпирически и решают Клапейрона-Клаузиуса уравнением численно.
Клапейрона-Клаузиуса уравнение применимо как к чистым веществам, так и к растворам и отдельным компонентам растворов. В последнем случае Клапейрона-Клаузиуса уравнение связывает парциальное давление насыщенного пара данного компонента с его парциальной теплотой испарения.
Литература
 1. Большой энциклопедический словарь, Под. ред. А.М. Прохорова.– М.: Большая Российская энциклопедия. 1999. Стр. 288.
1. Большой энциклопедический словарь, Под. ред. А.М. Прохорова.– М.: Большая Российская энциклопедия. 1999. Стр. 288.
 2. Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 1. - М.: Наука, 1969.
2. Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 1. - М.: Наука, 1969.
 3. Сивухин Д. В. Общий курс физики, Т. II. Термодинамика и молекулярная физика. - М.: Наука, 1975. - 519 с.
3. Сивухин Д. В. Общий курс физики, Т. II. Термодинамика и молекулярная физика. - М.: Наука, 1975. - 519 с.


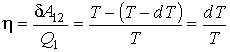 (1)
(1) (4)
(4)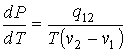 (5)
(5)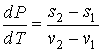 (8)
(8)![]() 1. Большой энциклопедический словарь, Под. ред. А.М. Прохорова.– М.: Большая Российская энциклопедия. 1999. Стр. 288.
1. Большой энциклопедический словарь, Под. ред. А.М. Прохорова.– М.: Большая Российская энциклопедия. 1999. Стр. 288.
![]() 2. Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 1. - М.: Наука, 1969.
2. Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 1. - М.: Наука, 1969.
![]() 3. Сивухин Д. В. Общий курс физики, Т. II. Термодинамика и молекулярная физика. - М.: Наука, 1975. - 519 с.
3. Сивухин Д. В. Общий курс физики, Т. II. Термодинамика и молекулярная физика. - М.: Наука, 1975. - 519 с.