|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Кельвина уравнение |
 |
Зависимость давления насыщенного пара от кривизны поверхности раздела двух сред
Описание
Кельвина уравнение, характеризует изменение давления пара жидкости или растворимости твердых тел, вызванное искривлением поверхности раздела смежных фаз (поверхности соприкосновения твердого тела с жидкостью или жидкости с паром). Так над сферическими каплями жидкости давление насыщенного пара р повышено по сравнению с его давлением po над плоской поверхностью при той же температуре Т. Соответственно, растворимость с твёрдого вещества с выпуклой поверхностью выше, чем растворимость с0 плоских поверхностей того же вещества. Кельвина уравнение получено У. Томсоном (Кельвином) в 1871 из условия равенства химических потенциалов в смежных фазах, находящихся в состоянии термодинамического равновесия, и имеет вид:
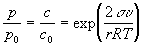
,
где r – радиус средней кривизны поверхности раздела фаз, σ – межфазное поверхностное натяжение, v – молярный объём жидкости или твёрдого тела, давление пара р или растворимость с которых фигурируют в уравнении, и R – газовая постоянная. Для шарообразных частиц r по абсолютной величине равен их радиусу.
Давления пара над жидкостью в зависимости от кривизны поверхности раздела фаз
Рис.1.
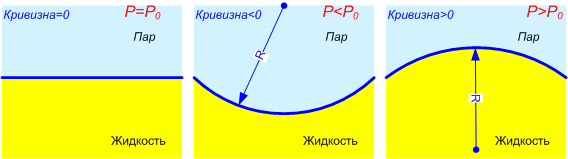
Понижение или повышение давления пара и растворимости, в соответствии с Кельвина уравнением зависит от знака кривизны поверхности рассматриваемого вещества (рис.1); повышение отвечает выпуклой поверхности (r > 0), а понижение – вогнутой (r < 0). Так, в отличие от рассмотренных выше случаев, давление пара в пузырьке или над поверхностью вогнутого мениска в капилляре понижено (р < po). Так как значения р и с различны для частиц разных размеров или для участков поверхностей, имеющих впадины и выступы, Кельвина уравнение определяет направление переноса вещества (от больших значений р и с – к меньшим) в процессе перехода системы к состоянию термодинамического равновесия. Это приводит, в частности, к тому, что крупные капельки или частицы растут за счет испарения (растворения) более мелких, а неровные поверхности сглаживаются за счёт растворения выступов и заполнения впадин. Заметные отличия давления и растворимости имеют место лишь при достаточно малых r.
Ключевые слова
Разделы наук
Применение эффекта
Кельвина уравнение наиболее широко используется для характеристики состояния малых объектов (частиц коллоидных систем, зародышей новой фазы) и при изучении капиллярных явлений.
На рисунке 1 приведен пример влияния мезопористости на изменение формы изотермы и перехода от изотермы типа II (кривая 1) к изотерме типа IV. Несовпадение ветвей адсорбции (2) и десорбции (3) свидетельствует о капиллярной конденсации, т.е. заполнении мезопор вследствие меньшего давления конденсации над вогнутой поверхностью жидкости в капиллярах, чем над плоской. Такое явление, когда ветви адсорбции и десорбции не совпадают, называется капиллярным гистерезисом. Вследствие разной смачиваемости поверхности капилляра жидкостью при формировании пленки адсорбата на поверхности пор при адсорбции (угол натекания) и при удалении жидкости из капилляров (угол оттекания) проявляется известный гистерезис смачивания, обсуждавшийся нами в главе 2. Капиллярная конденсация в мезопорах начинается при достаточно высоком относительном давлении (Р/Рs)>0,25 и уже по тому, при каком давлении происходит отклонение формы изотермы от типа II, можно определить тип пористости адсорбента.
Капиллярная конденсация в мезопорах делает возможным определение распределения пористого пространства по размерам пор. Для нахождения радиуса пор, заполненных при соответствующем равновесном давлении, используют уравнение Кельвина
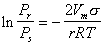
, (1)
где Pr, Ps–давление над мениском в капилляре и давление насыщения над плоской поверхностью, Vm– молярный объем жидкого адсорбата, s – поверхностное натяжение жидкого адсорбата, r – радиус кривизны мениска в капиллярах.
Влияние мезопористости на изотерму адсорбции газа на твердом адсорбенте. Изотермы: 1– непористый; 2, 3–мезопористый сорбенты; 2–адсорбция, 3–десорбция
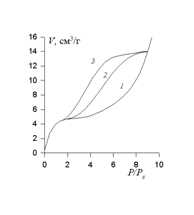
Рис. 1
Радиус пор рассчитывают как rп = r + t. Толщину t адсорбционного слоя необходимо определять при независимом определении адсорбции данного газа на непористом или макропористом адсорбенте той же природы, что мезопористый.
Уравнение (1) справедливо только для менисков сферической формы. Кроме того, предполагается, что жидкий адсорбат полностью смачивает поверхность адсорбента. Капиллярная конденсация будет происходить тогда, когда мениск в капиллярах, образовавшийся при адсорбции и формировании полимолекулярных слоев на первой стадии процесса, будет вогнутым.
Для расчета распределения пор мезопористого адсорбента по размерам используют определение адсорбции, считая реальным ее значение, соответствующее ветви десорбции. Объем пористого пространства можно рассчитать, учитывая, что W=ГVm. Отмечая то давление капиллярной конденсации, при котором находят адсорбцию, рассчитывают радиус капилляров, заполненных в результате капиллярной конденсации, и строят интегральную и дифференциальную кривые распределения. Равновесным считается значение адсорбции, соответствующее ветви десорбции.
Для построения интегральной кривой на оси ординат откладывают суммарный объем капилляров, соответствующий размерам от rmin до ri.
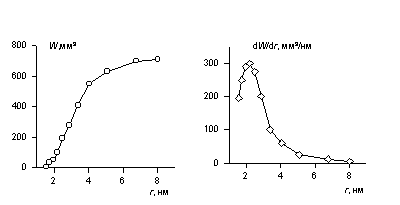
Для построения дифференциальной кривой проводят графическое дифференцирование интегральной кривой или рассчитывают значения DV при соответствующих значениях Dr, находят DV/Dr и тогда строят дифференциальную кривую как функцию от rср. Пример кривых распределения пористого пространства активированного угля, найденных по адсорбции азота, приведен на рисуноке 2
Интегральная (а) и дифференциальная (б) кривые распределения пористого пространства мезопористого адсорбента по адсорбции азота
Рис. 2
Реализации эффекта
Насыщенный пар — пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава.
Давление насыщенного пара обычно сильно зависит от температуры. При равенстве внешнего давления давлению насыщенного пара происходит кипение (жидкости).
При некоторой определённой температуре — температуре кипения, зависящей от внешнего давления на тело, парообразование начинается во всей массе тела и при достаточном притоке тепла извне к телу продолжается до тех пор, пока всё тело не перейдет в пар. Увеличивая внешнее давление, можно повышать температуру кипения, но лишь до определённого предела — критической температуры, выше которой тело при всяком давлении может существовать лишь в газообразном виде. Если поместить вещество в замкнутом пространстве при постоянной температуре, то образующийся из него пар будет мало-помалу заполнять пространство и, представляя газообразное тело, будет производить определённое давление на стенки сосуда и на вещество; это давление будет, согласно закону Дальтона, прилагаться к тому давлению, которое производят уже находящиеся в названной замкнутой оболочке другие газы, напр. воздух. По мере увеличения количества выделившегося пара будет расти и производимое им давление, а следовательно, и его упругость, но лишь до известного предела, после которого дальнейшее выделение пара прекращается (но не парообразование, см. испарение). Опыты показали, что при данной температуре выделение пара прекращается, независимо от сосуда и других наполняющих его газов, тогда, когда упругость пара достигла определённой величины, которую называют упругостью паров данного вещества, насыщающего пространство при данной температуре, или, сокращённо, упругостью насыщенного пара данного вещества при данной температуре. Разные вещества при одной и той же температуре имеют различнейшие упругости пара, насыщающего и пространство, как видно из следующей таблицы:
Упругость паров, насыщающих пространство (в миллиметрах ртутного столба), для температуры 20°С
Вещество (Давление наcыщенного пара)
Ртуть (0,0013)
Вода (17,36)
Хлороформ (160,5)
Сернистый углерод (198,5)
Эфир (442,4)
Сернистая кислота (H2SO3) жидкая (2162 (3,24 атм.))
Хлор жидкий (5798 (7,63 атм.))
Аммиак жидкий (6384 (8,4 атм.))
Углекислота жидкая (44688 (58,8 "))
Поверхностное натяжение — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Сила поверхностного натяжения направлена по касательной к поверхности жидкости, перпендикулярно к участку контура, на который она действует. Сила поверхностного натяжения пропорциональна длине того участка контура, на который она действует. Коэффициент пропорциональности α — сила, приходящаяся на единицу длины контура — называется коэффициентом поверхностного натяжения. Он измеряется в ньютонах на метр. Но более правильно дать определение поверхностному натяжению, как энергии (Дж) на разрыв единицы поверхности (м²). В этом случае появляется физический смысл и связь понятия поверхностного натяжения с внутренней энергией, что было доказано теоретически.
Поверхностное натяжение может быть на границе газообразных, жидких и твёрдых тел. Обычно имеется в виду поверхностное натяжение жидких тел на границе «жидкость — газ». В случае жидкой поверхности раздела поверхностное натяжение правомерно также рассматривать как силу, действующую на единицу длины контура поверхности и стремящуюся сократить поверхность до минимума при заданных объёмах фаз.
В общем случае прибор для измерения поверхностного натяжения называется тензиометр.
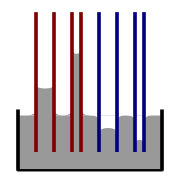
Иллюстрация подъеме и опускания уровня жидкости в капилляре. Красный - угол контакта меньше 90°, синий - угол контакта больше 90°.
Рис.1.
Литература
 1. С.Брунауэр, Адсорбция газов и паров, M., ИЛ, 1948.
1. С.Брунауэр, Адсорбция газов и паров, M., ИЛ, 1948.
 2. С. Грегг, К.Синг, Адсорбция, удельная поверхность, пористость, М., Мир, 1984.
2. С. Грегг, К.Синг, Адсорбция, удельная поверхность, пористость, М., Мир, 1984.
 3. Гиббс Дж. Термодинамика. Статистическая физика. М.: Наука, 1982.
3. Гиббс Дж. Термодинамика. Статистическая физика. М.: Наука, 1982.
 4. Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1987.
4. Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1987.
 5. W. T. Thomson, Phil. Mag. 42, 448 (1871)
5. W. T. Thomson, Phil. Mag. 42, 448 (1871)
 6. Adamson and Gast, Physical Chemistry of Surfaces, 6th edition, (1997) p.54
6. Adamson and Gast, Physical Chemistry of Surfaces, 6th edition, (1997) p.54



![]() 1. С.Брунауэр, Адсорбция газов и паров, M., ИЛ, 1948.
1. С.Брунауэр, Адсорбция газов и паров, M., ИЛ, 1948.
![]() 2. С. Грегг, К.Синг, Адсорбция, удельная поверхность, пористость, М., Мир, 1984.
2. С. Грегг, К.Синг, Адсорбция, удельная поверхность, пористость, М., Мир, 1984.
![]() 3. Гиббс Дж. Термодинамика. Статистическая физика. М.: Наука, 1982.
3. Гиббс Дж. Термодинамика. Статистическая физика. М.: Наука, 1982.
![]() 4. Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1987.
4. Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1987.
![]() 5. W. T. Thomson, Phil. Mag. 42, 448 (1871)
5. W. T. Thomson, Phil. Mag. 42, 448 (1871)
![]() 6. Adamson and Gast, Physical Chemistry of Surfaces, 6th edition, (1997) p.54
6. Adamson and Gast, Physical Chemistry of Surfaces, 6th edition, (1997) p.54