|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Бойля-Мариотта закон |
 |
Зависимость давления фиксированной массы газа от объема при постоянной температуре
Описание
Один из основных газовых законов, описывает изотермические процессы в газе. Согласно закону Бойля-Мариотта при постоянной температуре Т объем V данной массы газа помноженный на р остается постоянной величиной:
или
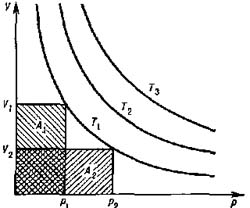
р-V–диаграммы состояния идеального газа при T = const (T1<T2<T3) представляют собой равносторонние гиперболы
рис.1
Установлен Р. Бойлем (R. Boylo) в 1662, в 1676 сформулирован также Э. Мариоттом (Е. Mariotte). Строго выполняется только для идеальных газов и является следствием уравнения Клапейрона. Закон Бойля-Мариотта описывает, как и уравнение Клапейрона, предельный случай поведения реального газа, более точно описываемого уравнением Ван-дер-Ваальса: для реальных газов закон Бойля-Мариотта выполняется приближенно – тем лучше чем дальше состояние от критического.
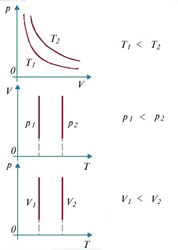
Графики изотермического процесса
рис.2
Кривую, изображенную на рисунке 2 называют изотермой, а процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
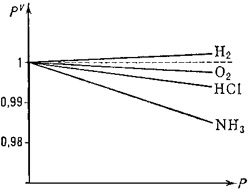
Отклонение поведения реальных газов от закона Бойля — Мариотта. Пунктир соответствует линии pV=C
рис.3
Закон Бойля-Мариотта, закон Шарля, закон Гей-Люссака образуют объединённый газовый закон. Основные газовые законы, дополненные законом Авогадро, образуют уравнение состояния идеального газа.
Ключевые слова
Разделы наук
Применение эффекта
Применение данного закона приближенно можно наблюдать в процессе сжатия воздуха компрессором или в результате расширения газа под поршнем насоса при откачке его из сосуда.
Изотермический процесс можно осуществить, изменяя объем газа при постоянной температуре. Изотермическим процессом является кипение жидкости или плавление твердого тела при постоянном давлении. При изотермическом процессе системе подводится (или от системы отводится) определенное количество теплоты и совершается внешняя работа. В твердом теле и большинстве жидкостей изотермические процессы очень мало изменяет объем тела, если только не происходит фазовый переход.
Для осуществления изотермического процесса систему обычно помещают в термостат, но можно применять источники или стоки тепла, контролируя постоянство температуры с помощью термометров. Если изотермический процесс происходит настолько медленно, что не нарушается термодинамическое равновесие с термостатом, то изотермический процесс обратим. Изотермические процессы, протекающие с конечной скоростью, необратимы. Для реализации изотермического процесса необходимо подводить или отводить от системы определенное количество теплоты. Примером необратимого изотермического процесса является изотермическое дросселирование.
Реализации эффекта
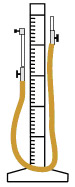
Манометр со шлангом
рис.1
Для экспериментально проверки закона служит манометр (рис.1). К шкале длиной свыше 2 м прикрепляются две подвижные стеклянные трубки, связанные толстостенным резиновым шлангом. Левая трубка закрывается стеклянным краном, правая – открыта. При открытом кране ртуть в обеих трубках стоит на одинаковых уровнях. При закрытии крана в левой трубке остается некоторое количество воздуха; при подъеме правого колена манометра воздух в левом колене сжимается. Разность высот уровней ртутных столбиков, сложенная с атмосферным давлением, дает давление замкнутого воздушного столбика.
Представим себе цилиндр с газом, который по своим свойствам близок к идеальному. Цилиндр закрыт поршнем. На поршне лежит горка песка. Цилиндр изготовлен из очень тонкого металла, который очень хорошо проводит тепло. Поставим цилиндр на нагреватель с постоянной температурой Т, которая практически равна температуре газа в цилиндре (на самом деле чуть-чуть выше). Будем снимать по одной песчинке с поршня. Он будет очень медленно подниматься. Давление газа будет падать (масса поршня уменьшается), объем - возрастать, а темпрература - оставаться постоянной (нагреватель будет все время подогревать газ).
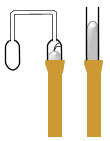
Воздушный термометр
рис.1
Отсчет производится как по манометру. Постоянный объем воздуха очень легко установить посредством впаянного в трубку стеклянного указателя. Нулевой отсчет производится при погружении колбы в тающий лед; при этом правое колено поднимается или опускается до тех пор, пока стеклянное острие не коснется мениска ртути. При погружении термометра в жидкость неизвестной температуры снова нужно установить тот же объем; при этом получают измеримое избыточное давление, которое дает возможность вычислить Т2.
Литература
 1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
 2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
 3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965
3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965


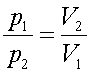
![]() 1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
![]() 2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
![]() 3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965
3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965