|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
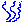 | Адиабатическое расширение газа в пустоту |
 |
Адиабатическое расширение газа в пустоту
Описание
Адиабатический процесс (так же, как и другие изопроцессы) является процессом квазистатическим. Все промежуточные состояния газа в этом процессе близки к состояниям термодинамического равновесия. Любая точка на адиабате описывает равновесное состояние.
Не всякий процесс, проведенный в адиабатической оболочке, т. е. без теплообмена с окружающими телами, удовлетворяет этому условию. Примером неквазистатического процесса, в котором промежуточные состояния неравновесны, может служить расширение газа в пустоту. На рис. 1 (а) изображена жесткая адиабатическая оболочка, разделённая на две части перегородкой. В первоначальном состоянии газ заполняет одну часть, а в другой – вакуум. После устранения перегородки (рис.1 б) газ расширяется, заполняет всю оболочку, и устанавливается новое равновесное состояние. В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируема. Из первого закона термодинамики следует: ∆U = 0, т. е. внутренняя энергия газа осталась неизменной. Так как внутренняя энергия идеального газа зависит только от температуры, температура газа в начальном и конечном состояниях одинакова – точки на плоскости (p, V), изображающие эти состояния, лежат на одной изотерме. Все промежуточные состояния газа неравновесны и их нельзя изобразить на диаграмме.
Расширение газа в «пустоту». Изменение энтропии
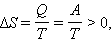
где A = Q – работа газа при обратимом изотермическом расширении.
Рисунок 1
Рисунок 1 иллюстрирует необратимый процесс расширения газа «в пустоту» в отсутствие теплообмена. Только начальное и конечное состояния газа в этом процессе являются равновесными, и их можно изобразить на диаграмме (p, V). Точки (a) и (b), соответствующие этим состояниям, лежат на одной изотерме. Для вычисления изменения ΔS энтропии можно рассмотреть обратимый изотермический переход из (a) в (b). Поскольку при изотермическом расширении газ получает некоторое количество теплоты от окружающих тел Q > 0, можно сделать вывод, что при необратимом расширении газа энтропия возросла: ΔS > 0.
Ключевые слова
Разделы наук
Используется в научно-технических эффектах
Используется в областях техники и экономики
Используются в научно-технических эффектах совместно с данным эффектом естественнонаучные эффекты
Применение эффекта
Что же будет, если расширению в пустоту подвергнуть неидеальный газ? Оказывается, температура такого (реального) газа при расширении уменьшается. Дело в том, что в реальных газах заметную роль играет притяжение между молекулами и связанная с этим притяжением потенциальная энергия взаимодействия между молекулами газа. При расширении среднее расстояние между молекулами увеличивается, силы притяжения совершают отрицательную работу, я потенциальная энергия увеличивается. А поскольку полная внутренняя энергия остается постоянной, кинетическая энергия молекул, а значит, и температура газа, уменьшаются. Наиболее Удачной И широко применяемой моделью реального газа является газ Ван-дер-Ваальса, подчиняющийся уравнению состояния
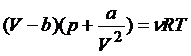
Постоянные Ван-дер-Ваальса а и b учитывают притяжение между молекулами на больших расстояниях (постоянная а) и сильное отталкивание на малых (постоянная b). Это отталкивание делает недоступным внутреннее пространство данной молекулы для остальных молекул и уменьшает общий свободный объем. Внутренняя энергия одного моля газа Ван-дер-Ваальса равна
что показывает уменьшение температуры при увеличении объёма при постоянной энергии.
Реализации эффекта
Мы теперь свяжем «механическую» скорость газа с его термодинамическими параметрами — давлением, температурой и плотностью. Механическая скорость здесь понимается как общая или макроскопическая скорость, в отличие от случайного теплового движения молекул. Мы применим уравнение Бернулли в форме, пригодной для сжимаемой жидкости. Рассмотрим струю газа при стационарном течении и вычислим ускорение элемента газа, заключённого между двумя близкими поперечными сечениями, каждое площадью А. Мы получим уравнение Бернулли
— dp = pvdv. (1)
Отрицательный знак показывает, что скорость растёт с уменьшением давления. Так как мы рассматриваем единицу массы, то р = 1/V , где V — удельный объём.
Взяв второй закон Ньютона, и комбинируя его с первым законом термодинамики, записанном через энтальпию, мы получаем:
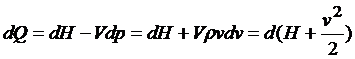
(2)
В то время как Η есть энтальпия единицы массы, второй член представляет кинетическую энергию единицы массы. Таким образом термодинамические величины связаны со скоростью движения газа, как целого, фундаментальным и практически важным соотношением. Если мы, далее, предположим, что поток совершает адиабатический процесс, например расширение в пустоту, то dQ=0 и интеграция (2) даёт:
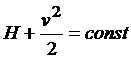
(3)
Согласно уравнению (3) в стационарном адиабатическом процессе сумма энтальпии и кинетической энергии единицы массы постоянны. Практически это меет место в большинстве случаев.
Далее, отношение, например, температур в двух точках адиабатного цикла может быть выражено простым степенным выражением от отношения значений любой другой переменной в этих точках. Эти соотношения особенно полезны, когда требуется вычислить параметр в любой точке ракетного сопла в зависимости от его значения в камере сгорания, где оно легче можетбыть измерено. Например,
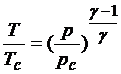
(4)
где индекс с означает, что величина относится к камере сгорания, а γ – показатель адиабаты. Из определяющего ср выражения и из постоянства ср в идеальном газе находим путём интегрирования:
Н = срТ+Но (5)
где Но — константа интегрирования. Подставляя (5) и (4) в (3) и используя выражение констант, получим
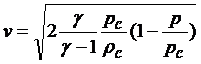
(6)
Где ρс - плотность внутри камеры, а р – внешнее давление, равное – 0 в вакууме.
Литература
 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
 2. 1948 УСПЕХИ ФИЗИЧЕСКИХ НАУК Т. XXXIV, вып. 1 ФИЗИКА РАКЕТЫ Говард С. Зейферт, Марк М. Миллс и Мартин Саммерфильд
2. 1948 УСПЕХИ ФИЗИЧЕСКИХ НАУК Т. XXXIV, вып. 1 ФИЗИКА РАКЕТЫ Говард С. Зейферт, Марк М. Миллс и Мартин Саммерфильд
 3. Журнал "Квант": "Внутренняя энергия идеального газа" А. Черноуцан 2000/№1
3. Журнал "Квант": "Внутренняя энергия идеального газа" А. Черноуцан 2000/№1


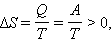 где A = Q – работа газа при обратимом изотермическом расширении.
где A = Q – работа газа при обратимом изотермическом расширении.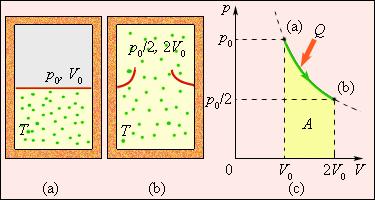
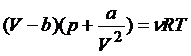
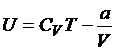
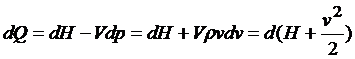 (2)
(2)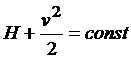 (3)
(3)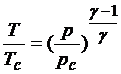 (4)
(4)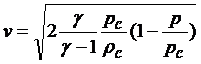 (6)
(6)![]() 1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
1. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
![]() 2. 1948 УСПЕХИ ФИЗИЧЕСКИХ НАУК Т. XXXIV, вып. 1 ФИЗИКА РАКЕТЫ Говард С. Зейферт, Марк М. Миллс и Мартин Саммерфильд
2. 1948 УСПЕХИ ФИЗИЧЕСКИХ НАУК Т. XXXIV, вып. 1 ФИЗИКА РАКЕТЫ Говард С. Зейферт, Марк М. Миллс и Мартин Саммерфильд
![]() 3. Журнал "Квант": "Внутренняя энергия идеального газа" А. Черноуцан 2000/№1
3. Журнал "Квант": "Внутренняя энергия идеального газа" А. Черноуцан 2000/№1