|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Коагуляция коллоидных частиц |
 |
Слипание коллоидных частиц
Описание
Коагуляция – слипание частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты – более крупные (вторичные) частицы, состоящие из скопления более мелких (первичных). Первичные частицы в таких скоплениях соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц (увеличением размера и массы агрегатов) и уменьшением их числа в объеме дисперсионной среды – жидкости или газа.
Различают быструю и медленную коагуляцию. При быстрой коагуляции почти каждое соударение частиц эффективно, то есть приводит к их соединению; при медленной коагуляции соединяется часть сталкивающихся частиц. В жидкой среде, например при коагуляции золей, укрупнение частиц до известного предела (приблизительно до размера 10-4 см) не сопровождается их оседанием или всплыванием. Это скрытая коагуляция, при которой система сохраняет седиментационную устойчивость. Дальнейший рост частиц приводит к образованию сгустков или хлопьев (флокул), выпадающих в осадок (коагулят, коагель) или скапливающихся в виде сливок у поверхности; это явная коагуляция. В некоторых случаях при коагуляции во всём объёме дисперсионной среды возникает рыхлая пространственная сетка (коагуляционная структура) и расслоения системы не происходит. Если коллоидные частицы - капельки жидкости или пузырьки газа, то коагуляция может завершиться их слиянием, коалесценцией.
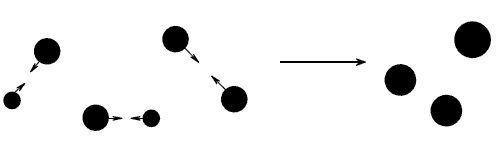
Коагуляция частиц
Рис.1
Коагуляция наступает в результате проявления сил тяжести. Достигнув известной величины, частицы становятся уже неспособными удерживаться во взвешенном состоянии и выделяются из той среды, в которой они были распределены, – происходит седиментация коллоида. Как следует из изложенного, коагуляция представляет собой процесс укрупнения частиц золя, а седиментация – результат этого процесса. Однако термином коагуляции часто охватывают и то и другое вместе.
Важнейшим фактором, противодействующим коагуляции, является наличие на коллоидных частицах электрических зарядов. Вследствие одноименности последних движущимся навстречу друг другу частицам лишь в крайне редких случаях удается сойтись настолько близко, чтобы между ними могли достаточно эффективно проявиться силы стяжения. В результате содержащий сильно заряженные коллоидные частицы золь заметно не коагулирует даже при долгом хранении, то есть является весьма устойчивым.
Очевидно, что снятие с коллоидных частиц их электрического заряда (хотя бы частичное) должно понижать устойчивость золей и способствовать их коагуляции. Такое разряжение в случае гидрозолей может быть проще всего достигнуто добавлением к коллоидному раствору электролитов. Хотя при этом вводится одинаковое число положительных и отрицательных зарядов, но в непосредственно окружающей коллоидную частицу «ионной атмосфере» всегда несколько преобладают ионы, противоположна ей заряженные, которые частицей преимущественно и адсорбируются. Так как введение электролита сильно повышает общую концентрацию ионов в растворе, условия для их адсорбции становятся весьма благоприятными и первоначальный заряд частиц быстро нейтрализуется, следствием чего является коагуляция золя. Природный процесс коагуляции электролитами широко осуществляется в устьях рек, где приносимые последними коллоиды и взвеси осаждаются под действием солей морской воды.
Коагуляция – самопроизвольный процесс, который, в соответствии с законами термодинамики, является следствием стремления системы перейти в состояние с более низкой свободной энергией. Однако такой переход затруднен, а иногда практически невозможен, если система агрегативно устойчива, то есть способна противостоять укрупнению (агрегированию) частиц.
Ключевые слова
Разделы наук
Используется в научно-технических эффектах
Используется в областях техники и экономики
Используются в научно-технических эффектах совместно с данным эффектом естественнонаучные эффекты
Применение эффекта
Коагуляция играет важную роль во многих технологических, биологических, атмосферных и геологических процессах. Так, при нагревании биополимеров (белков, нуклеиновых кислот) и при некоторых др. воздействиях на них, например изменении pH, наблюдается их коагуляция. Явления коагуляция во многих биологических дисперсных системах (например, крови, лимфе) важны в связи с вопросами их агрегативной устойчивости. Очистка природных и сточных вод от высокодисперсных механических примесей, борьба с загрязнением воздушного пространства аэрозолями, выделение каучука из латекса, получение сливочного масла и др. пищевых продуктов - характерные примеры использования коагуляция в практических целях. Нежелательна коагуляция при получении и хранении суспензий, эмульсий, порошков и других дисперсных систем промышленного или бытового назначения.
В случае гидрофобных коллоидов коагуляция электролитами обычно происходит легко и для достижения седиментации достаточно уже сравнительно небольших концентраций ионов. Напротив, коагуляция гидрофильных коллоидов, частицы которых покрыты слоем адсорбированных молекул воды, часто идет значительно труднее и их седиментация иногда наступает лишь при высоких концентрациях электролита.
Осадки коллоидов (коагуляты) имеют различную структуру. Лиофобные коллоиды при седиментации не увлекают с собой жидкую фазу и выпадают в виде тонких порошков или хлопьев. Напротив, лиофильные коллоиды увлекают более или менее значительные количества жидкой фазы, что и обусловливает студенистый характер их осадков. Золи некоторых лиофильных коллоидов (например, желатины) даже нацело застывают в студнеобразную массу (желе, студень). Подобные коагуляты, содержащие в своем составе увлеченную жидкую фазу, называют обычно гелями (для воды в качестве жидкой фазы – гидрогелями).
Защитой от коагуляции при этом может быть электрический заряд и (или) адсорбционно-сольватный слой на поверхности частиц, препятствующий их сближению. Нарушить агрегативную устойчивость можно, например, повышением температуры (термокоагуляция), перемешиванием или встряхиванием, введением коагулирующих веществ (коагулянтов) и другими видами внешнего воздействия на систему. Минимальная концентрация введенного вещества, электролита или неэлектролита, вызывающая коагуляцию в системе с жидкой дисперсионной средой, называется порогом коагуляции. В полидисперсных системах, где частицы имеют разную величину, можно наблюдать ортокинетическую коагуляцию – налипание мелких частиц на более крупные при их оседании или всплывании. Слипание однородных частиц называется гомокоагуляцией, а разнородных - гетерокоагуляцией или адагуляцией. Гетерокоагуляция часто происходит при смешении дисперсных систем различного состава. Коагуляция может наступить без какого-либо внешнего воздействия на коллоидную систему (автокоагуляция) как результат физических или химических изменений, происходящих при её старении. Иногда коагуляция обратима; в благоприятных условиях, особенно при введении поверхностно-активных веществ, понижающих поверхностную межфазную энергию и облегчающих диспергирование, возможен распад агрегатов на первичные частицы (пептизация) и переход коагеля в золь.
Реализации эффекта
Помимо коагуляции или флокуляции, при которых подобные друг другу частицы слипаются в крупные агрегаты (гомокоагуляция), в практике часто наблюдаются процессы, когда имеет место слипание разнородных частиц (гетерокоагуляция) или прилипание частиц дисперсной системы к вводимой в систему чужеродной поверхности (гетероадагуляция).
Явление взаимной коагуляции или гетерокоагуляции коллоидов, наблюдавшееся еще Пиктоном и Линдером в 1897 г., объясняли действием противоположных зарядов частиц дисперсной фазы обоих золей, в результате чего происходит слипание частиц. При этом считали, что для полной коагуляции необходимо, чтобы золи были взяты в таком количественном соотношении, которое обеспечивало бы более или менее полную нейтрализацию заряда частиц. Однако последующие исследования установили, что взаимная коагуляция коллоидных систем может наблюдаться и тогда, когда частицы обоих золей несут электрический заряд одного и того же знака.
Гетероадагуляция, наблюдающаяся, например, при отложении коллоидных или более грубодисперсных частиц на волокне, имеет большое значение при дублении, крашении, проклеивании бумажной массы при получении бумаги, в процессах получения водоотталкивающих тканей и т. д.
Согласно взглядам С. И. Соколова и С. С. Воюцкого, основанным на представлениях, развитых ранее Н. П. Песковым, причиной потери устойчивости дисперсных систем в присутствии чужеродной поверхности является адсорбция стабилизатора этой поверхностью и снижение вследствие этого содержания стабилизатора в золе.
Не так давно Б. В. Дерягин предложил общую теорию взаимодействия и слипания разнородных частиц, основанную на тех же положениях, из которых он исходил при рассмотрении гомокоагу-ляции, и позволяющую объяснить коагуляцию, происходящую как при взаимодействии двух золей, так и при введении в коллоидную систему чужеродной поверхности.
Некоторые исследователи установили, что у органозолей с достаточно большой диэлектрической проницаемостью среды обнаруживаются явления электрофореза и существует известная корреляция между электрофоретической подвижностью частиц и устойчивостью этих систем. Таким образом, в органозолях, так же, как и в гидрозолях, коллоидные частицы могут нести двойной электрический слой и обладать потенциалом. Установлено также, что во многих случаях для органозолей справедливы закономерности, которым подчиняются и гидрозоли. К ним приложимо правило Шульце—Гарди, при их коагуляции наблюдаются явления аддитивности и антагонизма при действии ионов и т. д. Таким образом, есть все основания считать, что к золям с неводной дисперсионной средой с известными коррективами приложима физическая теория коагуляции.
Понятно, что в связи с меньшей диэлектрической проницаемостью среды и, следовательно, меньшей диссоциацией молекул стабилизующего электролита заряд частиц органозолей обычно невелик. Однако в связи с малой емкостью двойного электрического слоя на частицах органозоля этот слой весьма диффузен и обладает большой толщиной, вследствие чего для возникновения электростатических сил отталкивания достаточны даже малые заряды. В общем, органо-золи гораздо менее устойчивы, чем гидрозоли.
Наличие у коллоидных частиц двойного электрического слоя далеко не всегда является причиной устойчивости органозолей. Устойчивость органозолей может обусловливаться и сольватацией частиц в результате физического или химического взаимодействия среды с дисперсной фазой.
К вопросу об устойчивости коллоидных систем в неводных средах тесно примыкает вопрос о потере устойчивости гидрозолей при добавлении к ним некоторых неэлектролитов. Известно, что коагуляцию гидрозолей могут вызывать в больших концентрациях такие вещества, как этиловый спирт, ацетон, сахара. Коагулирующее действие неэлектролитов объясняется тем, что они понижают диссоциацию молекул, содержащихся в системе стабилизующих электролитов, или вызывают десольватацию коллоидных частиц; это и приводит в конечном счете к коагуляции золя.
Литература
 1. Наука о коллоидах под редакцией Г. Кройта, том 1, 1955г. Стр.2-18.
1. Наука о коллоидах под редакцией Г. Кройта, том 1, 1955г. Стр.2-18.
 2. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
2. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.


![]() 1. Наука о коллоидах под редакцией Г. Кройта, том 1, 1955г. Стр.2-18.
1. Наука о коллоидах под редакцией Г. Кройта, том 1, 1955г. Стр.2-18.
![]() 2. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.
2. Физическая энциклопедия / гл.ред. Прохоров А.М. - М.: Большая российская энциклопедия. 1994.