|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Спин-орбитальное взаимодействие |
 |
Спин-орбитальное взаимодействие
Описание
Спин-орбитальное взаимодействие - это взаимодействие между магнитными моментами, связанными со спиновыми и орбитальными моментами количества движения электронов и ядер в квантовой системе - атоме, молекуле, кристалле и т.п. Спин-орбиальное взаимодействие обусловливает вклад в энергию системы, которому отвечают три слагаемых гамильтониана в уравнении Шредингера. Первое слагаемое связано с магнитным полем, возникающим при перемещении электрона относительно ядра в электрическом поле ядра и действующим на спиновый магнитный момент; второе - с магнитным полем, возникающим при движении данного электрона в электрическом поле всех остальных электронов, третье - с взаимодействием спинового магнитного момента данного электрона с магнитными полями, создаваемыми всеми остальными электронами при их движении.
Для электронов i и j с радиусами-векторами ri и rj и импульсами (Моментами количества движения) pi и pj их спин-орбитальное взаимодействие друг с другом и с ядрами а, заряды которых равны Za (в единицах элементарного заряда е) и радиусы-векторы Ra, приводит к дополнительному вкладу в гамильтониан системы.
Из этого вклада, как правило, основной вклад в энергию системы спин-орбитального взаимодействия сводится к следующему:
Hsol=∑I,aξialixSi,
где ξiа – функции координат электронов и ядер, а также зарядов ядер. Эти функции пропорциональны Ria-3, поэтому при их усреднении по всем возможным положениям электронов наиболее существенны те конфигурации системы, при которых электроны находятся вблизи ядер. Обычно функции <ξia>(ri, Ra) для атомов заменяют на некоторые постоянные, зависящие от главного n и орбитального l квантовых чисел (ξnl); их называют постоянными спин-орбитального взаимодействия. В водородных атомах ξnl пропорциональна Z4 и обратно пропорциональна n3. В многоэлектронных атомах происходит экранирование ядра электронами и зависимость постоянной спин-орбитальное взаимодействие от Z и n становится не столь резко выраженной и функционально более сложной. Тем не менее и в том и в другом случае спин-орбитальное взаимодействие наиболее велико для электронов внутренних оболочек тяжелых атомы, а у молекул – для внутренних оболочек атомных остовов, что позволяет характеризовать величины спин-орбитального взаимодействия и для молекул с помощью атомных постоянных ξnl.
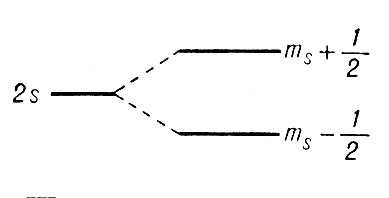
Расщепление уровня энергии во внешнем магнитном поле.
Рис.1
Ключевые слова
Разделы наук
Применение эффекта
Спин-орбитальное взаимодействие приводит к расщеплению вырожденных уровней мультиплета, что проявляется в атомных и молекулярных спектрах как тонкая структура. Так, вследствие спин-орбитального взаимодействия низший возбужденный уровень атомов щелочных металлов расщепляется на два: 2P1/2 и 2Р3/2, где индекс внизу указывает квантовое число полного момента количества движения электронов на внешней оболочке. Для Na (Z = 11, n = 3) это расщепление составляет 17,2см-1, для К (Z=19, n = 4) 57,7 см -1, для Cs (Z =55, n = 6) 554,1 см -1. У галогенов расщепление уровней для np-электронов еще больше, а постоянные спин-орбитального перехода таковы: для F 272 см -1, для Сl 587 см -1, для I 5060 см -1. При достаточно сильном спин-орбитальном взаимодействии понятие мультиплетности термов вообще теряет смысл и рассматривается лишь полный момент количества движения электронов, а не спин и орбитальный момент в отдельности. Запрет на квантовые переходы между уровнями с разной мультиплетностью при наличии спин-орбитального взаимодействия снимается, что приводит, например, к фосфоресценции – излучательному переходу из состояний с временами жизни, обратно пропорциональными квадратам матричных элементов оператора спин-орбитального взаимодействия, и к ин-теркомбинационная конверсии. Поскольку время фосфоресценции зависит не только непосредственно от времени жизни "фосфоресцирующего" состояния рассматриваемых молекул, но и от среды, в которой они находятся, для учета этой зависимости вводят представление о межмолекулярном спин-орбитальном взаимодействии. У двухатомных и линейных многоатомных молекул соотношение спин-орбитально взаимодействия и других взаимодействий, например спин-вращательного, позволяет выделять различные случаи связи спинов, орбитальных и других моментов, что дает возможность для каждого случая связи проводить специфическую классификацию квантовых состояний молекулы.
Реализации эффекта
Парамагнитные частицы, исследуемые методом электронного парамагнитного резонанса (ЭПР), как правило, не являются свободными атомами. Воздействие анизотропных электрических полей, окружающих атомов, расщепление зеемановских уровней в нулевом внешнем магнитном поле и другие эффекты часто приводят к существенным отклонениям g-фактора от чисто спинового значения и к его анизотропии (зависимости g-фактора от ориентации образца во внешнем магнитном поле). Значительные отклонения g-факторов от чисто спинового значения g = 2,0023, как мы уже отмечали выше, наблюдаются при наличии достаточно сильного спин-орбитального взаимодействия. Если спиновый и орбитальный моменты в атоме отличны от нуля, то за счет взаимодействия спинового и орбитального моментов ( спин-орбитальное взаимодействие) энергетические уровни могут дополнительно расщепиться. В результате этого вид спектра ЭПР усложнится и вместо одной спектральной линии в спектре ЭПР появятся несколько линий. В этом случае говорят о том, что спектр ЭПР имеет тонкую структуру. При наличии сильного спин-орбитального взаимодействия расщепление зеемановских уровней может наблюдаться даже при отсутствии внешнего магнитного поля.
Литература
 1. Физика. Большой энциклопедический словарь. Гл. ред. А.М. Прохоров. – изд. – М.: Большая российская энциклопедия, 1999г. стр. 714
1. Физика. Большой энциклопедический словарь. Гл. ред. А.М. Прохоров. – изд. – М.: Большая российская энциклопедия, 1999г. стр. 714
 2. Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963.
2. Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963.


 Атомная физика, излучение и поглощение энергии атомами и молекулами
Атомная физика, излучение и поглощение энергии атомами и молекулами Квантовая механика
Квантовая механика Релятивистская механика
Релятивистская механика![]() 1. Физика. Большой энциклопедический словарь. Гл. ред. А.М. Прохоров. – изд. – М.: Большая российская энциклопедия, 1999г. стр. 714
1. Физика. Большой энциклопедический словарь. Гл. ред. А.М. Прохоров. – изд. – М.: Большая российская энциклопедия, 1999г. стр. 714
![]() 2. Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963.
2. Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963.