|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
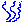 | Политропный процесс |
 |
Политропный процесс
Анимация
Описание
Политропный процесс (политропический процесс) – обратимый термодинамический процесс при постоянной теплоёмкости системы. Линия, изображающая политропный процесс на термодинамической диаграмме, называется политропой. При политропном процессе количество подводимого тепла δQ пропорционально вызываемому тем самым повышению температуры dT, следовательно, δQ = CdT, где С – теплоёмкость при политропном процессе. Для идеального газа внутренняя энергия U пропорциональна температуре U = СvТ, так что, согласно первому началу термодинамики,
где Р – давление, V – объём, Сv – теплоёмкость при постоянном объёме. Интегрируя полученное уравнение с учётом уравнения состояния, находим уравнение для политропы идеального газа:
Где
С - теплоемкость политропного процесса, Сp - теплоемкость процесса при постоянном давлении, Сv теплоемпость при постоянном объеме. n – показатель политропы, который может принимать любое значение от – до + , но для данного газа постоянен.
Изменение энтропии при политропном процессе равно
так как
Теплоемкость политропных процессов равна
где k=Cp/Cv показатель адиабаты.
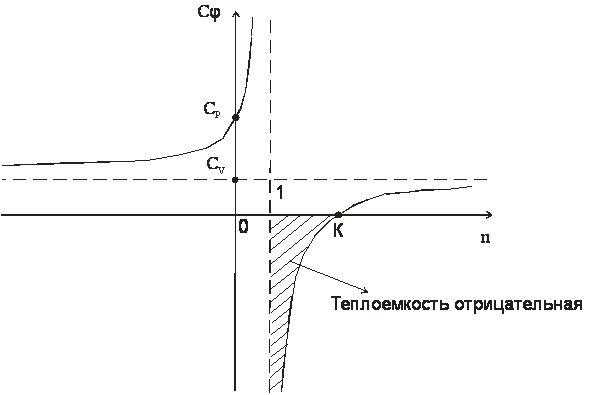
рис.1
Зависимость теплоемкости от показателя политропы
В диапазоне 1<n<k теплоемкость процессов отрицательная, т.е. с подводом теплоты температура системы уменьшается, а с отводом теплоты - увеличивается.Смысл отрицательной теплоемкости заключается в том, что вся подведенная теплота расходуется на работу и, кроме этого, на работу затрачивается еще и часть внутренней энергии системы.
Работа расширения/сжатия в политропном процессе равна:
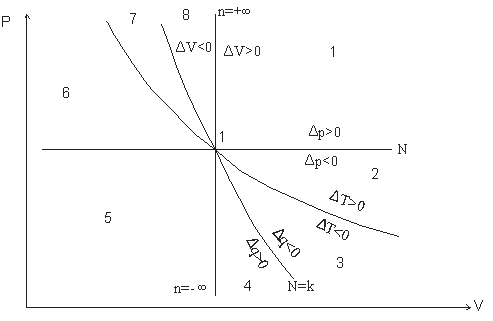
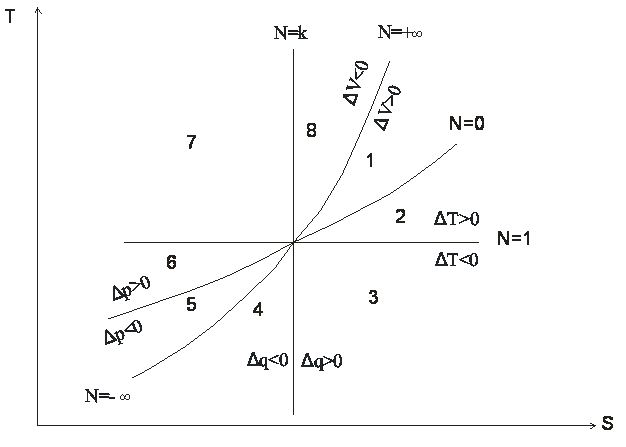
Для анализа политропных процессов удобно пользоваться обобщенной диаграммой. На ней изображаются все изопроцессы и выделяются области, в пределах которых знаки слагаемых I закона одинаковы.
рис.2
Рабочая диаграмма
рис.3
Тепловая диаграмма
Диаграмма позволяет проанализировать любой политропный процесс и определить условия, при которых этот процесс может быть реализован, то есть, как распределяется теплота между внутренней энергией и работой, что будет с температурой системы и т.д.
1. Любой процесс, лежащий выше изобары проведённой через точку 1 сопровождается ростом давления.
2. Любой процесс, лежащий выше изотермы сопровождается ростом температуры, внутренней энергии и энтальпии.
3. Любой процесс, лежащий правее адиабаты сопровождается ростом энтропии и подводом теплоты.
4. Любой процесс, лежащий правее изохоры идёт с ростом объёма и работа в процессе положительна.
Ключевые слова
Разделы наук
Применение эффекта
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
|
процесс
|
C |
n |
|
T=const
|
±∞
|
1
|
|
p=const
|
Cp
|
0
|
|
v=const
|
Cv
|
±∞
|
|
q=const
|
0
|
k
|
Термодинамические циклы используются в тепловых машинах для превращения тепловой энергии (то есть, внутренней энергии) в механическую работу, а также для охлаждения (при использовании обратного цикла). Тепловая машина состоит из рабочего тела, которое и проходит цикл, нагревателя и холодильника (с помощью которых меняется состояние рабочего тела). Теория теория термодинамических процессов применяется для проектирования двигателей, холодильных установок, в химической промышленности, в метеорологии.
Реализации эффекта
В ограниченном диапазоне высот ( до 11 км) в соответствии с опытом принимают, что температура с высотой в атмосфере убывает по линейному закону:
Где T0=288K – абсолютная температура при z=0, а Δ – величина, на которую убывает температура при подъеме на 100 м. В ряде практических вопросов для атмосферы принимают Δ=0.65K и что z=0 соответствует уровню моря. В этом случае имеем
Высота атмосферы конечная, p=0 при
Поэтому очевидно, что это допущение неприемлемо для всей атмосферы. Установим связь между плотностью ρ и давлением p для такой атмосферы. Имеем
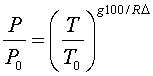
а из уравнения Клапейрона
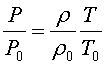
поэтому
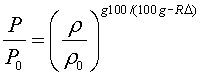
или
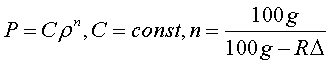
Литература
 1. Прохоров А.М. Большая Советская энциклопедия М.: Советская энциклопедия. Т. 1. 1994. 704 с
1. Прохоров А.М. Большая Советская энциклопедия М.: Советская энциклопедия. Т. 1. 1994. 704 с
 2. Баскаков А.П. Теплотехника. М.:Энергоиздат,1991
2. Баскаков А.П. Теплотехника. М.:Энергоиздат,1991
 3. Седов Л.И. Механика сплошной среды. Том 2.М.:Наука,1970
3. Седов Л.И. Механика сплошной среды. Том 2.М.:Наука,1970


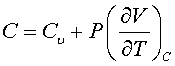
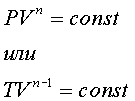
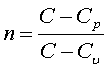
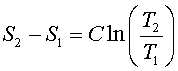
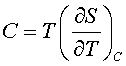
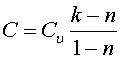
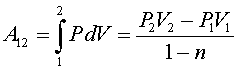
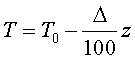
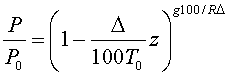
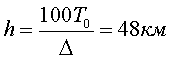
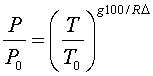
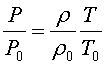
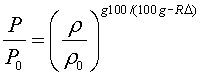
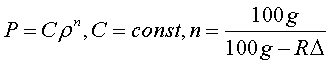
![]() 1. Прохоров А.М. Большая Советская энциклопедия М.: Советская энциклопедия. Т. 1. 1994. 704 с
1. Прохоров А.М. Большая Советская энциклопедия М.: Советская энциклопедия. Т. 1. 1994. 704 с
![]() 2. Баскаков А.П. Теплотехника. М.:Энергоиздат,1991
2. Баскаков А.П. Теплотехника. М.:Энергоиздат,1991
![]() 3. Седов Л.И. Механика сплошной среды. Том 2.М.:Наука,1970
3. Седов Л.И. Механика сплошной среды. Том 2.М.:Наука,1970