|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Первое начало термодинамики |
 |
Превращение энергии в тепловых процессах
Анимация
Описание
Первое начало термодинамики - это закон сохранения и превращения энергии в самом общем его виде, т.е. учитывающий любые формы движения материи. В более образном выражении - это утверждение о невозможности существования вечного двигателя I рода, т. е. такого устройства, которое, воспроизводя свое первоначальное состояние, совершало бы полезную работу, не требуя при этом никаких энергетических затрат.
Непосредственным следствием I начала является вывод об однозначности внутренней энергии Е как функции термодинамического состояния. При этом величина Е просто является интегралом движения в том смысле, как это понимается в механике, и соответственно не должно возникать никакой "неоднозначности" значения энергии E. Если же предположить, что при одном и том же наборе переменных (θ, V, a, N) существуют два макроскопически различных значения внутренней энергии E'(θ, V, a, N) > Е"(θ, V, a, N), то без изменения термодинамического состояния рассматриваемой системы и окружающих ее тел мы могли бы выделить энергию ΔЕ = Е' - Е" и использовать ее с какой-либо целью, нарушив тем самым I начало термодинамики.
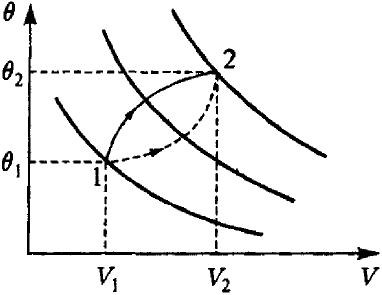
Однозначность внутренней энергии Е(θ, V, a, N) означает, что эта величина имеет свойство потенциала в том смысле, что изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 зависит только от начального и конечного состояний системы, сам же процесс перехода 1→2 (рис.1) может быть любым, даже неквазистатическим. В связи с этим в случае, когда состояния 1 и 2 «дифференциально» близки друг к другу, это изменение внутренней энергии Е2 - Е1 будем обозначать дифференциальным символом dЕ.
Запишем теперь I начало термодинамики для частного случая перехода термодинамической системы из некоторого исходного состояния в близлежащее другое, параметры которого отличаются от исходного на макроскопические бесконечномалые величины. В нашем распоряжении три энергетические величины, из них δW и δQ характеризуют связи системы с окружающими ее телами, а dЕ - изменение внутренней энергии самой системы. Итак, I начало применительно к процессу указанного типа представляется в естественной форме баланса энергии: бесконечно малое изменение внутренней энергии dЕ происходит за счет того, что система поглощает количество тепла δQ, совершает работу δW и, если число частиц в системе N не фиксировано, за счет изменения его на величину dN:
dЕ = δQ-δW + μdN,
где термодинамическая величина μ - химический потенциал - это изменение внутренней энергии Е, связанное с таким способом добавления одной частицы в систему, когда она при этом не совершает работы и не получает тепла.
Первое начало термодинамики. Уровни постоянных значений внутренней энергии газа.
Рис.1
Ключевые слова
Разделы наук
Используется в научно-технических эффектах
Используется в областях техники и экономики
Используются в научно-технических эффектах совместно с данным эффектом естественнонаучные эффекты
Применение эффекта
Так как первое начало термодинамики по сути является законом сохранения энергии, то казалось бы оно должно выполняться в самом широком числе возможных ситуаций. Однако это не совсем верно. Применимость первого начала строго ограничена рамками исследования определенных систем - термодинамических систем.
Под термодинамическими системами понимаются такие система, для которых выполняются ряд признаков.
1. Это системы большого числа взаимодействующих друг с другом и внешними полями частиц. Фигурирующее общепринятое и широко используемое словосочетание «большое число» в данном контексте представляет совершенно определенное понятие: это означает, что число частиц N в системе измеряется не штуками, а в масштабе числа Авогадро.
2. Для каждой термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает. Сформулированный тезис составляет так называемое нулевое начало термодинамики. Термин "состояние термодинамического равновесия" означает такое состояние, когда макроскопические параметры системы не изменяются с течением времени и когда в системе отсутствуют потоки любого типа.
3. По отношению к термодинамическим системам имеет место термодинамический принцип аддитивности. Он состоит в утверждении, что все величины, характеризующие или описывающие термодинамические свойства статистических систем, могут принадлежать только к одному из двух классов аддитивности.
а. Если значение термодинамической величины при делении системы на части ведет себя как Fобщ = F1 + F2, то такая величина называется аддитивной.
б. Если значение термодинамической величины при делении статистической системы сохраняется для каждой ее части Fобщ = F1 = F2, то такую величину мы будем называть неаддитивной.
4. По отношению к термодинамическим системам справедливы I, II и III начала термодинамики.
Реализации эффекта
Представим себе материальную систему, в которой может протекать химическая реакция по стехиометрическому уравнению:
νAA + νBB + ... = νLL + νMM + ...
где ν - стехиометрические коэффициенты; А, В, L, М - символы реагирующих веществ.
Пусть эта реакция идет при t, р = const без совершения полезной работы, т. е. w = 0; ΔH = Q - приращение энтальпии системы, вызванное протеканием реакции в указанных условиях, равно количеству энергии, поглощенной системой из внешней среды в форме теплоты, или, короче: равно количеству теплоты, поглощенной системой. Эту величину называют теплотой реакции, тепловым эффектом, или (что правильнее) приращением энтальпии при реакции.
Тепловой эффект реакции при р = const часто обозначают символом Qp. Энтальпию (тепловой эффект) реакции ΔH всегда относят к одинаковой температуре исходных (1) и конечных (2) веществ:
ΔH = (H2)t - (H1)t
Однако в процессе протекания реакции температура системы может изменяться любым образом, если все время поддерживается р = const, то:
ΔH = ΣQ
где в правой части стоит сумма всех количеств теплоты, полученных системой в течение реакции и при доведении температуры конечной системы до исходной температуры.
Так как ΔH - экстенсивная величина, то мы условимся всегда относить ее к такому количеству моль реагирующих веществ, которое соответствует стехиометрическим коэффициентам уравнения. Часто приращение энтальпии относят к 1 моль одного из образующихся веществ. Например, теплота образования (приращение энтальпии при образовании) 1 моль NH3 соответствует реакции (при t, р = const, w'=0): 1/2N2 + 3/2H2 → NH3.
Аналогичным образом легко показать, что для реакций, протекающих в условиях V, t = const и w' =0, приращение внутренней энергии описывается уравнением: ΔU = Q, т. е. равно количеству энергии, поглощенной системой в форме теплоты из внешней среды в этом процессе (теплота реакции при V = const). В большинстве случаев приходится иметь дело с реакциями, протекающими при р = const, поэтому соотношения, связанные с энтальпией, имеют для химии большее значение, чем связанные с внутренней энергией. В однородной среде химические реакции при V = const практически возможны только в газах. В случае твердых или жидких систем (растворов) провести реакцию в условиях строгого постоянства объема мы не можем. Однако с помощью соотношений, которые дает термодинамика, можно рассчитать приращение внутренней энергии, отвечающее такой реакции.
Литература
 1. Квасников И.А. Термодинамика.т1.Теория равновесных систем. - М.: УРСС. 2002.
1. Квасников И.А. Термодинамика.т1.Теория равновесных систем. - М.: УРСС. 2002.
 2. Базаров И.П. Термодинамика. - М.: Высшая школа. 1991.
2. Базаров И.П. Термодинамика. - М.: Высшая школа. 1991.


 Взаимодействие потоков частиц с веществом
Взаимодействие потоков частиц с веществом Реальные газы
Реальные газы Явления переноса
Явления переноса Термодинамика
Термодинамика Идеальный газ
Идеальный газ Плазмодинамика
Плазмодинамика![]() 1. Квасников И.А. Термодинамика.т1.Теория равновесных систем. - М.: УРСС. 2002.
1. Квасников И.А. Термодинамика.т1.Теория равновесных систем. - М.: УРСС. 2002.
![]() 2. Базаров И.П. Термодинамика. - М.: Высшая школа. 1991.
2. Базаров И.П. Термодинамика. - М.: Высшая школа. 1991.