|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Генри закон |
 |
Пропорциональность между парциальным давлением газа и его концентрацией в разбавленном растворе
Анимация
Описание
Закон Генри – это положение, согласно которому при постоянной температуре растворимость газа в данной жидкости (выраженная его весовой концентрацией) прямо пропорциональна давлению этого газа над раствором. При этом под растворимостью понимается способность вещества образовывать с другими веществами однородные системы. В такой формулировке закон был установлен У. Генри в 1803 г. Закон Генри применяется в химии предельно-разбавленных растворов. Предельно-разбавленным называется раствор, в котором концентрация растворенного вещества бесконечно мала.
При изучении химии растворов удобной системой сравнения свойств раствора является идеальный раствор – раствор, для компонент которого при всех составах и температурах выполняется закон Рауля, рассмотрение которого является важным для изучения закона Генри.
Согласно закону Рауля, давление пара растворителя pi над раствором пропорционально мольной доле растворителя xi в растворе
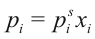
,
где pi – давление насыщенного пара компонента i над раствором, pis - давление насыщенного пара над чистым компонентом, xi – мольная доля i-го компонента в растворе.
В реальных предельно-разбавленных растворах для растворителя выполняется закон Рауля, а для растворенного вещества – закон Генри, в современной формулировке выглядящий следующим образом. При постоянной температуре парциальное давление psolute, растворенного вещества над его предельно разбавленным раствором пропорционально мольной доле этого вещества xsolute:
psolute = KГxsolute,
где КГ – постоянная Генри для вещества.
Таблица 1 – Константы Генри некоторых газов для воды
|
Газ
|
H2
|
He
|
N2
|
O2
|
CO2
|
| КГ |
1311
|
2649
|
1610
|
773
|
29.3
|
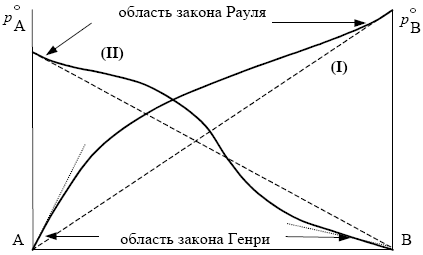
В идеальных растворах закон Генри совпадает с законом Рауля (КГ = ps). В реальных растворах могут наблюдаться различные отклонения от закона Рауля (рис. 1).
Закон хорошо соблюдается только для идеальных растворов и применим лишь в области невысоких давлений, приобретая при этом характер предельного закона.
Изотермы давления пара в системе с положительными (I) и знакопеременными (II) отклонениями от закона Рауля
Рис. 1
Ключевые слова
Разделы наук
Применение эффекта
Закон Генри – основной закон, определяющий термодинамические свойства предельно разбавленных растворов неэлектролитов. Так, если для идеального разбавленного бинарного раствора выполняется закон Генри, то из уравнения Гиббса – Дюгема и общих законов термодинамического равновесия следует, что парциальное давление пара растворителя над таким раствором при постоянной температуре пропорционально мольной доле растворителя, а понижение температуры замерзания раствора (если его компоненты не образуют твердых растворов) пропорционально мольной доле растворенного вещества и не зависит от его химической природы. В области выполнения газового закона или, иначе говоря, в идеальном разбавленном растворе термодинамические активности растворенных веществ пропорциональны их мольным долям (при любом способе выбора стандартных состояний). При выборе в качестве стандартного состояния для растворенного вещества гипотетического состояния при N=1, в котором вещество обладало бы свойствами, соответствующими предельно разбавленному раствору в данном растворителе, его активность становится равной мольной доле, а коэффициент активности – единице. Благодаря этому при записи условий химического равновесия в разбавленных растворах неэлектролитов можно опускать коэффициент активности и использовать закон действующих масс в его наиболее простой форме.
Реализации эффекта
Это заболевание известно абсолютно всем подводникам. Группа риска по кессонной болезни включает в себя подводников, пилотов, космонавтов. Болезнь возникает при резком изменении давления, например, при быстром всплытии с глубины. По закону Генри при резком понижении давления доля азота, растворенного в крови, резко уменьшается. Освобожденный азот образует пузырьки, которые, сливаясь, могут блокировать кровообращение (закупорить мелкие сосуды и капилляры) и физически повредить ткани (например, вызвать разрыв сосуда, что может привести к смерти, если разрыв происходит в головном мозге).
Гипербарическая оксигенация – это лечение кислородом под повышенным давлением в барокамерах. Принципы, на которых основывается данный метод, во многом обусловлены законами физики, регулирующими растворение газов в жидкостях организма и их распространение в тканях.
Кислород в крови находится в химически связанном с гемоглобином состоянии (19,1 % об.), а также в растворенном в плазме (0,3 % об.). В нормальных условиях доставку кислорода к тканям осуществляет гемоглобин, находящийся в эритроцитах, а растворенная фракция лишь регулирует этот процесс. При всех заболеваниях, когда доставка кислорода к органам и тканям нарушена, развивается гипоксия (кислородное голодание).
Гипоксия может наступить по различным причинам – это и нарушение проходимости сосудов, кровоснабжающих орган (атеросклероз, воспаление, отек и пр.), и понижение количества гемоглобина, и множество иных причин, связанных с патологией дыхания, сердечной деятельностью и пр. Для лечения этих состояний разработаны различные способы кислородотерапии (оксигенотерапии). Однако при нормальном атмосферном давлении даже дыхание чистым кислородом часто не в состоянии устранить кислородную недостаточность на уровне клеток органов и тканей. Единственным способом решить эту проблему является увеличение количества кислорода, переносимого кровью. Последнее возможно только при повышении давления кислорода, так как в силу закона Генри под давлением газы лучше растворяются в жидкостях. Под давлением в условиях барокамеры кислород, растворяясь в плазме и межтканевой жидкости в необходимых количествах, попадает в органы и ткани, куда не доходит гемоглобин.
Таким образом, удается ликвидировать кислородное голодание в больном органе, восстановить его функцию и сопротивляемость к болезнетворным факторам. Кроме того, согласно современным представлениям, кислород под повышенным давлением выступает в качестве общего адаптогена, повышающего сопротивляемость организма к различным стрессовым воздействиям. Помимо этого, гипербарическая оксигенация оказывает целый ряд эффектов, благоприятно влияющих на состояние больного: противоотёчное действие; противовоспалительное действие; ускоряет течение раневого процесса, способствует разрастанию сосудистых капилляров и восстанавливает сниженный кровоток в органах и тканях. Гипербарическая оксигенация нормализует синтез коллагена, ускоряет образование костной мозоли, ликвидирует явления остеопороза и пр. Нельзя не отметить ещё одно важное преимущество применения метода гипербарической оксигенации – этот метод позволяет свести к минимуму применение лекарственных средств. Применяя данный метод (отдельно или в комплексе с другими методами), удалось добиться хороших результатов в лечении многих заболеваний, существенно сократить сроки выздоровления, помочь ослабленному организму справиться с последствиями болезни, а также улучшить качество жизни у больных с рядом тяжелых хронических заболеваний.
Баротерапия (от греч. baros – тяжесть и терапия), лечебное воздействие на организм повышенным или пониженным атмосферным давлением. Баротерапия обусловлена влиянием измененного атмосферного давления на сосудистую систему, функцию дыхания и газовый обмен. Баротерапия осуществляется специальными аппаратами или проводится в барокамерах, наиболее совершенные из которых позволяют регулировать не только атмосферное давление, но и влажность, температуру воздуха, а также содержание положительных и отрицательных аэроионов. В некоторых случаях в барокамеры вмонтированы источники света для одновременного облучения больных ультрафиолетовыми, инфракрасными и др. лучами. Баротерапию назначают местно при ангиоспазмах, облитерирующем эндартериите, миалгиях, невралгиях и др. Общая баротерапия показана при негнойных воспалительных заболеваниях дыхательных путей, бронхиальной астме и др. Баротерапия противопоказана при склонности к кровотечениям, гемофилии, туберкулёзе лёгких и дыхательных путей.
Литература
 1. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
1. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
 2. Карапетьянц М.X. Химическая термодинамика. – 3 изд. – М., 1975.
2. Карапетьянц М.X. Химическая термодинамика. – 3 изд. – М., 1975.


![]() 1. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
1. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи. – М.: Экзамен, 2005.
![]() 2. Карапетьянц М.X. Химическая термодинамика. – 3 изд. – М., 1975.
2. Карапетьянц М.X. Химическая термодинамика. – 3 изд. – М., 1975.