|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Закон Дальтона |
 |
Дальтона закон о давлении газовой смеси
Описание
Закон Дальтона устанавливает, что давление смеси (идеальных) газов составляет сумму парциальных давлений компонент смеси (парциальное давление компоненты – это давление, которое компонента оказала бы, если бы она одна занимала все пространство, занятое смесью). Этот закон указывает, что на каждую компоненту не воздействует присутствие других компонент и свойства компоненты в смеси не меняются.
Другой закон Дальтона - при постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорционально его парциальному давлению
Теперь обобщим закон Дальтона, полагая, что для смеси идеальных газов энергия и энтропия также равны сумме энергий и энтропии (парциальных энергий и парциальных энтропии), которые каждая компонента имела бы, если бы она одна занимала весь объем, занятый смесью, при той же температуре, что и смесь.
Из определений и свободной энергии и термодинамического потенциала при постоянном давлении непосредственно следует, что для смеси идеальных газов эти величины соответственно равны сумме парциальных свободных энергий и сумме парциальных термодинамических потенциалов при постоянном давлении компонент смеси. Исходя из этих предположений, мы можем написать выражение для свободной энергии рассматриваемой смеси газов. Свободная энергия одного моля газа А ± представлена, выражением:
Концентрация газа А± в объеме V составляет [Ai]. Это значит, что всего имеется V[Ai] молей газа А±. Поэтому парциальная свободная энергия этой компоненты смеси составляет
Свободную энергию всей системы получаем, суммируя парциальные свободные энергии всех ее компонент. В результате суммирования для всей свободной энергии имеем
Теперь рассмотрим бесконечно малую реакцию, т. е. реакцию, в которой в превращении принимают участие бесконечно малые количества вещества. Если реакция происходит слева направо, то бесконечно малые количества газов исчезают и образуются бесконечно малые количества газов.
Части молей газов, которые исчезают, пропорциональны соответственно коэффициентам, а части молей, образующихся в результате реакции газов B1,B2,...,BS. Следовательно, концентрации [A1], [А2],... и [В±], [Вr] подвергаются изменениям
где ε является бесконечно малой константой пропорциональности.
Ключевые слова
Разделы наук
Применение эффекта
Примером закона Дальтона может служить процесс диффузии газа через полупроницаемую перегородку (мембрану). Пусть в начальный момент два разных газа занимают две половины сосуда, разделенные полупроницаемой мембраной. Температуры обоих газов и их начальные давления одинаковы. Мембрана полностью непроницаема для одного из газов и частично прозрачна для другого. В процессе диффузии газа через полупроницаемую перегородку давление в одной половине сосуда возрастает в соответствии с законом Дальтона, а в другой – падает. Это явление носит название осмоса.
Реализации эффекта
Теоретическое нахождение давления смеси реальных газов является очень трудной задачей. Рассмотрим частный случай смеси неплотных неидеальных газов. Как известно, для таких газов уравнением состояния является уравнение Ван-дер-Ваальса:
или
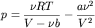
,
где p,T,v – давление, температура и количество молей газа, соответственно, R – универсальная газовая постоянная, a и b – константы, характеризующие силы притяжения и отталкивания между молекулами газа. Для неплотных газов, когда , можно записать вириальное разложение:
Видно, что давление реального газа отличается от давления идеального на величину, пропорциональную bRT-a , которая может быть как больше, так и меньше нуля (все определяется тем, какие силы между молекулами преобладают - отталкивания или притяжения). Допустим, мы смешиваем два неплотных реальных газа, у которых константы a и b идентичны (например, изотопы). Тогда:
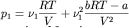
,
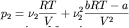
,
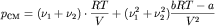
,
где p1, p2, pCM – давление первого газа, второго газа и их смеси соответственно.
Легко получить, что
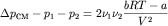
.
Таким образом, при давление смеси газов будет больше суммы парциальных давлений, при давление смеси газов будет меньше суммы парциальных давлений, а при закон Дальтона будет выполняться.
Литература
 1. Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. Кол. Д.М. Алексеев, А.м. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др. – М.: Большая Российская энциклопедия. Т.1., 1994.
1. Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. Кол. Д.М. Алексеев, А.м. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др. – М.: Большая Российская энциклопедия. Т.1., 1994.
 2. Савельев И. В. Курс общей физики. т.3. Молекулярная физика и термодинамика. - М.:АСТ.2005.
2. Савельев И. В. Курс общей физики. т.3. Молекулярная физика и термодинамика. - М.:АСТ.2005.


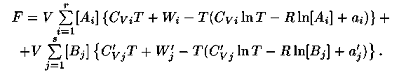
![]() 1. Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. Кол. Д.М. Алексеев, А.м. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др. – М.: Большая Российская энциклопедия. Т.1., 1994.
1. Физическая энциклопедия / Гл. ред. А.М. Прохоров. Ред. Кол. Д.М. Алексеев, А.м. Балдин, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др. – М.: Большая Российская энциклопедия. Т.1., 1994.
![]() 2. Савельев И. В. Курс общей физики. т.3. Молекулярная физика и термодинамика. - М.:АСТ.2005.
2. Савельев И. В. Курс общей физики. т.3. Молекулярная физика и термодинамика. - М.:АСТ.2005.