|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Клапейрона-Менделеева уравнение |
 |
Уравнение состояния идеального газа
Анимация
Описание
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Уравнение Клапейрона-Менделеева - зависимость между параметрами идеального газа (давлением p, объёмом V и абсолютной температурой Т), определяющими его состояние.
Уравнением Менделеева–Клапейрона:
pV = mRT/M,
где р – давление, V – объем, m – масса, М – молярная масса, R – универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 ДжДмоль • К)).
Установлено французским учёным Б. П. Э. Клапейроном (В. P. Е. Clapeyron) в 1834. В 1874 Д.И. Менделеев вывел уравнение состояния для одного моля идеального газа; pV=RT
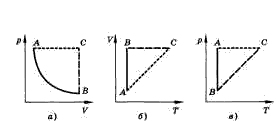
Уравнение Менделеева–Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре – температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля–Мариотта:
pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля:
V = const, p/T = const.
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид
V/T = const
и называется законом Гей-Люссака. Все процессы можно изобразить графически (рисунок 1).
Процессы реальных газов
Рис.1
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
Ключевые слова
Разделы наук
Используется в научно-технических эффектах
Используется в областях техники и экономики
Используются в научно-технических эффектах совместно с данным эффектом естественнонаучные эффекты
Применение эффекта
Уравнение Клапейрона представляет собой уравнение состояния идеального газа, которое объединяет Бойля – Мариотта закон, Гей-Люссака закон и Авогадро закон.
Уравнение Клапейрона – наиболнее простое уравнение состояния, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах.
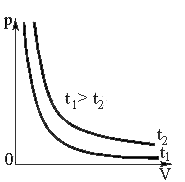
а) Закон Бойля – Mаpuomma: при неизменных температуре и массе произведение численных значений давления и объема газа постоянно:
pV = const
Графически этот закон в координатах РV изображается линией, называемой изотермой (рисунок 1).
Изотерма
Рис.1
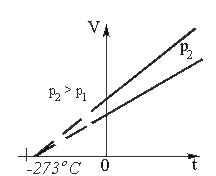
б) Закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
V = V0(1 + αt)
где V – объем газа при температуре t, °С; V0 – его объем при 0°С. Величина α называется температурным коэффициентом объемного расширения. Для всех газов α = (1/273°С–1). Следовательно,
V = V0(1 +(1/273)t)
Графически зависимость объема от температуры изображается прямой линией – изобарой (рисунок 2). При очень низких температурах (близких к –273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
Зависимость объема от температуры
Рис.2
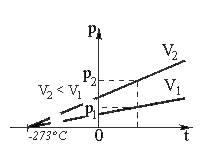
в) Закон Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
p = p0(1+gt)
где р0 – давление газа при температуре t = 273,15 К.
Величина g называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов = 1/273 °С–1. Таким образом,
p = p0(1 +(1/273)t)
Графическая зависимость давления от температуры изображается прямой линией – изохорой (Рисунок 3).
Изохора
Рис.3
г) Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул; или, что то же самое: при одинаковых давлениях и одинаковых температурах грамм-молекулы различных идеальных газов занимают одинаковые объемы.
Так, например, при нормальных условиях (t = 0°C и p = 1 атм = 760 мм рт. ст.) грамм-молекулы всех идеальных газов занимают объем Vm = 22,414 л.• Число молекул, находящихся в 1 см3 идеального газа при нормальных условиях, называется числом Лошмидта; оно равно 2,687*1019> 1/см3.
Реализации эффекта
Холодильные процессы обеспечивают непрерывное искусств, охлаждение различных веществ (тел) путем отвода от них теплоты. Естественное охлаждение с помощью холодной воды или воздуха позволяет охладить вещество до температуры охлаждающей среды и не требует подвода энергии. Охлаждение до более низких температур происходит в искусственных холодных средах, на создание которых расходуется механическая, тепловая или химическая энергия. Охлаждение до температур выше 120 К принято наз. умеренным, ниже – глубоким или криогенным.
Искусственные холодные среды. Для их получения необходим перенос теплоты с низкого на более высокий температурный уровень, которым, как правило, является температура окружающей среды. Этот перенос осуществляется с использованием т. наз. обратимых круговых термодинамических циклов, которые в промышленности обычно реализуются в холодильных установках. В последних холодная среда создается с помощью рабочих тел, наз. холодильными агентами или просто хладагентами (вода, NH3, пропан-пропиленовые смеси, хладоны, сжиженные газы - воздух, N2, Н2, Не и др.).
В лабораторной практике холодные среды получают, приготовляя т. наз. охлаждающие смеси- системы из двух или несколько твердых (либо твердых и жидких) веществ, при смешении которых вследствие поглощения теплоты при плавлении или растворении происходит понижение температуры. Наиболее употребительны смеси из льда и NaCl, твердого СО2 и этанола (-77 °С) и др. Для достижения криогенных температур в лабораториях применяют сжиженные газы, напр. N2.
Термодинамические основы получения холода. Согласно второму началу термодинамики, указанный выше перенос теплоты самопроизвольно не происходит, требуя затрат работы. В термодинамических процессах подвод или отвод теплоты q описывается через изменение энтропии dS системы: dq = TdS, где Т - температура. Отсюда следует, что при подводе к телу теплоты его энтропия возрастает, а при отводе теплоты - уменьшается. В непрерывных X. п. хладагент должен принять теплоту от охлаждаемого тела на нижнем температурном уровне, отдать теплоту на верх. уровне к.-л. теплоприемнику и вернуться в исходное состояние. Поэтому в установившемся процессе суммарная энтропия хладагента не изменяется (dS=0). Поскольку при передаче теплоты от охлаждаемого тела энтропия хладагента повышается, в любой холодильной установке должен проходить иной (компенсирующий) процесс, при котором энтропия хладагента уменьшается. В общем случае энтропия м. б. представлена как функция температуры и к.-л. другого параметра тела (напр., давление, фазовое состояние, степень намагниченности). Поэтому, если имеется изотермический или близкий к нему процесс, в котором наблюдается значит. изменение энтропии при изменении иного параметра, то подобный процесс можно рассматривать как потенциальную основу для создания холодильных установок. К таким процессам относятся, напр., изотермические процессы сжатия либо адсорбции газов, намагничивания парамагнетиков и сверхпроводников. При этом низкая температура достигается соотв. в адиабатических процессах расширения и десорбции газов, размагничивания парамагнетиков и сверхпроводников.
Перечисленные и иные процессы искусств. охлаждения в большинстве случаев осуществляются: 1) путем теплообмена между охлаждаемыми веществами и хладагентами – испаряющимися низкокипящими жидкостями, температура которых за счет уменьшения энтальпии i понижается до температуры кипения при давлении испарения; 2) изоэнтальпийным (i = const) расширением газов, предварительно сжатых в компрессорах, или жидкостей при их прохождении через сужение (вентиль, кран, пористая перегородка), т. е. их дросселированием (процесс протекает адиабатически без совершения внеш. работы) с использованием эффекта Джоуля – Томсона, или дроссельного эффекта, – отрицательные либо положительные изменения температуры тела при отсутствии подвода к телу или отвода от него теплоты; 3) адиабатическим (изоэнтропийным, S = const) расширением газов с совершением внеш. работы в т. наз. детандерах - машинах, устроенных подобно поршневому компрессору или турбокомпрессору; 4) сочетанием обоих методов расширения. Эти и другие методы получения холода рассмотрены ниже.
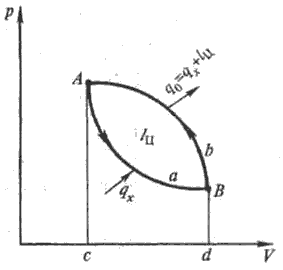
Принцип работы холодильных установок. Его удобно иллюстрировать с помощью идеального (воображаемого) холодильного процесса (цикла) в координатах р - V (рисунок 1; р, V- давление в системе и ее объем). При сжатии в компрессоре (процесс ВbА)рабочего тела его температура Т повышается; при этом в окружающую среду с т-рой Т0 передается удельная (на единицу кол-ва хладагента) теплота q0 (площадь AbBdcA) и энтропия рабочего тела понижается; в конце сжатия Т = Т0. При послед. расширении (процесс АаВ)хладагента его температура понижается. Затем к нему от охлаждаемой среды переносится теплота qx (площадь AaBdcA)и энтропия рабочего тела возрастает.
Повторяя указанные процессы, получают непрерывный круговой холодильный цикл с постоянной холодопроизводительностью qx (кол-во теплоты, отнимаемой от охлаждаемого тела). Расходуемая в цикле механическая работа lц (площадь АаВbА), параметры q0 и qx по закону сохранения энергии связаны между собой выражением: q0 = qx + lц. Энергетические показатели цикла характеризуются т. наз. холодильным коэффициентом ε = qx/lц.
Идеальный холодильный цикл
Рис.1
Литература
 1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
 2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
 3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965
3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965


![]() 1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
1. Прохоров А.М Физическая энциклопедия М.: Большая Российская энциклопедия. Т.1., 1994
![]() 2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
2. Фриш С.Э., Тиморева А.В. Курс общей физики. Физические основы механики. Молекулярная физика. Колебания и волны. т. 1. М.:1962
![]() 3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965
3. Рейф Ф. Берклеевский курс лекций: статистическая физика (Том 5), 1965