|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Гидролизный аппарат |
 |
Гидролизный аппарат
Описание
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии.
Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. "вольтова столба" - первого в истории человечества химического источника тока - были сформулированы проблемы, решение которых определило основные задачи электрохимии. "Без химии путь к познанию истинной природы электричества закрыт" - сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия.
Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления, происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими.
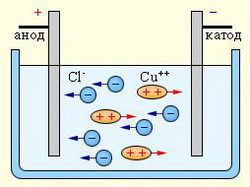
Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
Электролиз водного раствора хлорида меди
Рисунок 1
Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов.
Отличительной особенностью электролиза растворов или расплавов электролитов является возможность протекания на электродах совокупности конкурирующих химических реакций окисления и восстановления. Оказывает влияние на продукты электролиза и материал электродов.
При электролизе водных растворов электролитов окислительно-восстановительные процессы на катоде и аноде зависят от окислительной способности катионов и характера аниона электролита.
Процессы восстановления и окисления на катоде и аноде определяются значениями электродных потенциалов частиц, принимающих участие в электролитических процессах. На катоде в первую очередь разряжаются те частицы, потенциал которых наиболее положителен, тогда как на аноде – частицы – потенциал которых наиболее электроотрицателен. Кроме того, при протекании электролиза необходимо учитывать фактор электродного перенапряжения – поляризацию электрода, определяемую замедленным протеканием определенной стадии суммарного электродного процесса. В зависимости от природы замедленной стадии можно говорить о различных видах перенапряжения (концентрационное, реакционное, диффузное).
Ключевые слова
Области техники и экономики
Используемые естественнонаучные эффекты
Разделы естественных наук используемых естественнонаучных эффектов
Применение эффекта
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода.
Алюминий, магний, натрий, кадмий, кальций, бериллий, титан получают только электролизом расплавов, т.к. потенциалы их выделения из водных растворов более отрицательны, чем потенциал выделения водорода.
Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Производство фтора основано на электролизе расплавленной смеси фторида калия и фтороводородной кислоты, хлора – при электролизе водных растворов или расплавов хлоридов. Водород и кислород высокой степени чистоты получают электролизом водных растворов щелочей. Таким образом, с помощью электролиза удается осуществлять реакции окисления и восстановления с большим выходом и высокой селективностью, которые в обычных химических процессах трудно достижимы.
Важной отраслью применения электролиза является защита металлов от коррозии: при этом электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота) устойчивого к коррозии.
Реализации эффекта
Гидролизные производства служат для получения пищевых, кормовых и технических продуктов из непищевого растительного сырья - отходов лесозаготовок, лесопиления и деревообработки (опилки, мелкая стружка, щепа), переработки сельско-хозяйственных культур (соломы, шелухи семян и т.д.). Основой гидролизного производства служит гидролиз сырья, продукты которого подвергают дальнейшей химической и биохимической переработке.
Гидролиз происходит обычно в присутствии разбавленных или концентрированных минеральных и органических кислот, реже - солей, дающих в водных растворах кислую реакцию. В результате гидролиза (превращение полисахаридов сырья в моносахариды) получают гидролизаты (водные растворы органических веществ, главным образом пентоз и гексоз), а также гидролизный лигнин (выход около 30% - здесь и далее в расчете на 1 т абсолютно сухого сырья). Поскольку на скорость и степень гидролиза полисахаридов влияет размер частиц сырья, его предварительно измельчают.
Гидролиз разбавленными кислотами (в основном 0,4-0,7%-ной H2SO4) осуществляют при 120-190°С и 0,6-1,5 МПа. Достоинства способа: можно использовать влажное сырье и проводить реакцию без регенерации кислоты вследствие малого ее расхода. Недостатки: большие затраты теплоты на гидролиз, значительные потери моносахаридов из-за их разложения в реакционной зоне, загрязнение гидролизатов побочными продуктами, что снижает их качество. Тем не менее, простота процесса определила интенсивное развитие данного способа, который являлся основным в гидролизной промышленности СССР.
Гидролиз концентрированными кислотами (главным образом 30-41%-ной НС1, а также 70-80%-ной H2SO4) ведут при температурах не выше 60 °С и атмосферном давлении с получением гидролизатов, содержащих большое количество моносахаридов и немного примесей. Однако в этом процессе необходимо высушивать растительное сырье, регенерировать кислоту и применять дефицитные материалы для защиты оборудования от коррозии.
Условия гидролиза и состав образующихся при этом продуктов в значительной степени определяются наличием в растительной ткани двух фракций полисахаридов - легкогидролизуемых (гемицеллюлозы) и трудногидролизуемых (целлюлоза и небольшая часть гемицеллюлоз); скорость гидролиза последних в несколько сотен раз меньше. С повышением температуры и концентрации кислоты скорость гидролиза полисахаридов возрастает.
Литература
 1. Н.Л. Глинка "Общая химия." Москва, 1985г. 250-253; 257-261с.
1. Н.Л. Глинка "Общая химия." Москва, 1985г. 250-253; 257-261с.
 2. Н.В.Коровина. "Курс общей химии." Высш. шк., 1991. 378-380 с.
2. Н.В.Коровина. "Курс общей химии." Высш. шк., 1991. 378-380 с.
 3. Т.Браун, Г.Ю.Лемей "Химия в центре наук" Мир, 1997. Москва. 432-440с.
3. Т.Браун, Г.Ю.Лемей "Химия в центре наук" Мир, 1997. Москва. 432-440с.


 Технологии органических веществ и продуктов
Технологии органических веществ и продуктов Технологии неорганических веществ и продуктов
Технологии неорганических веществ и продуктов Технологии и техника обогащения полезных ископаемых
Технологии и техника обогащения полезных ископаемых Молекулярная электроника
Молекулярная электроника Источники тока
Источники тока Электрические машины
Электрические машины![]() 1. Н.Л. Глинка "Общая химия." Москва, 1985г. 250-253; 257-261с.
1. Н.Л. Глинка "Общая химия." Москва, 1985г. 250-253; 257-261с.
![]() 2. Н.В.Коровина. "Курс общей химии." Высш. шк., 1991. 378-380 с.
2. Н.В.Коровина. "Курс общей химии." Высш. шк., 1991. 378-380 с.
![]() 3. Т.Браун, Г.Ю.Лемей "Химия в центре наук" Мир, 1997. Москва. 432-440с.
3. Т.Браун, Г.Ю.Лемей "Химия в центре наук" Мир, 1997. Москва. 432-440с.