|
|

 |
|
Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии
|
Общий каталог эффектов
 | Компрессор |
 |
Машина для подачи газов, давление на выходе которой больше чем на входе
Описание
Компрессор представляет собой машину для подачи газов. Его отличие от других машин (вентиляторов, газодувок) для подачи газовых сред состоит в том, что, во-первых, компрессор сжимает газ при степени повышения давления (то есть отношении давления на выходе из машины к давлению на входе) больше 1,15, а, во-вторых, полости, в которых происходит сжатие газа, искусственно охлаждаются.
Компрессоры характеризуются следующими параметрами: объемной подачей (то есть объемом газа, перемещаемым машиной в единицу времени), начальным и конечным давлениями, частотой вращения и мощностью на валу компрессора.
По принципу действия компрессоры делятся на объемные и динамические. В объемных компрессорах энергия передается газовой среде в рабочих камерах, периодически изменяющих объем и попеременно сообщающихся с входом и выходом насоса. Динамический компрессор — машина с непрерывным потоком, в которой при протекании газа происходит рост давления газа. Вращающиеся лопатки компрессора ускоряют газ до высокой скорости, после чего скорость газа при расширении преобразуется в давление и соответственно уменьшается.
В зависимости от конструкции объемные компрессоры делятся на поршневые и роторные, а динамические – на радиальные (центробежные) и осевые, струйные.
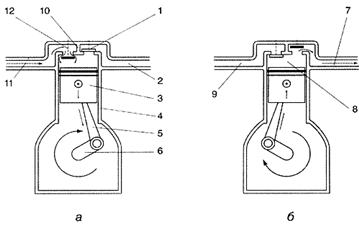
В поршневых компрессорах (Рисунок 1) последовательно осуществляются четыре фазы: расширение, всасывание, сжатие и выталкивание. Сначала воздух всасывается в камеру сжатия, после чего закрывается впускное отверстие. Затем объем камеры уменьшается и воздух сжимается. Когда давление достигает того же уровня, что и давление в выпускном коллекторе, воздух выпускается при постоянном давлении и продолжающемся уменьшении объема камеры.
Поршневой компрессор
Рис.1.
В роторных компрессорах происходит вращение массивного ротора, в продольных пазах которого могут свободно вращаться стальные пластины. Газ захватывается в межлопастные пространства, переносится от всасывающего патрубка к напорному и вытесняется.
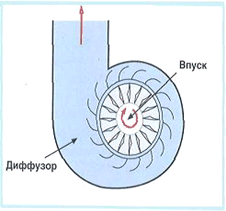
В радиальных компрессорах (Рисунок 2) газ непрерывно всасывается в рабочую область, содержащую вращающийся диск с лопастями, который закреплен на валу. Под действием центробежных сил газ повышает свою энергию, выбрасывается в спиральный клапан и выбрасывается.
Радиальный компрессор
Рис.2.
Осевой компрессор имеет ротор, состоящий из нескольких рядов рабочих лопаток. Рабочие лопатки, вращаясь, давят на газ, в результате чего он сжимается и перемещается параллельно оси компрессора.
Для описания принципа работы компрессора используются первый закон термодинамики и уравнение состояния идеального газа. Это приводит к следующим уравнениям процессов, происходящих с газом: адиабатический (pvγ=const), изотермический (pv=const), политропный (pvn=const - общий вид термодинамического процесса). На практике оказывается, что адиабатический процесс не осуществим, так как за счет внутреннего трения в газе выделяется значительное количество тепла. А также не возможно изотермическое сжатие газа в силу конструктивных особенностей машины. Поэтому реальными процессами являются только политропные процессы (n≠1, n≠γ).
Компрессоры являются преобразователями механической энергии в тепловую. По закону сохранения энергии работа, затрачиваемая на сжатие и выталкивание (без учета механических потерь) представляется суммой теплот, отводимых от газа в процессах сжатия и изобарного охлаждения.
Ключевые слова
Области техники и экономики
Применение эффекта
Компрессоры используются в различных областях науки и техники, где нужно создавать повышенное давление или откачивать газ или жидкость:
1. в трубопроводном транспорте для доставки природного газа от места производства к потребителю
2. на нефтеперерабатывающих заводах, заводах по переработке газа, нефтехимических и химических заводах и подобных больших индустриальных заводах для сжатия промежуточных и конечно произведенных газов
3. в охлаждении и воздушных кондиционерах для перемещения теплоты из одного места в другое
4. для заключения газа в маленьком объеме, баллонах высокого давления для медицинских целей, сварки и др.
5. в различных индустриальных, производственных и строительных процессах для всех типов пневматических инструментов
6. в герметичных летательных аппаратах для создания атмосферы с более высоким давлением чем окружающее давление
7. в некоторых типах реактивных двигателей для обеспечения горения топлива
8. в дайвинге, гипербарической оксигенации и других устройствах поддержания жизнедеятельности для накопления дыхательного газа в малом объеме, таком как баллоны для дайвинга
9. в субмаринах для накопления воздуха для регулировки глубины
Реализации эффекта
Реализация простейшей системы подачи воздуха может быть достигнута путем создания устройства, схематически приведенного на рисунке 1.
Электроматор вращает колесо с лопатками, в результате чего воздух засасывается в одном месте и выпускается в другом при большем давлении.
Схема радиального компрессора.
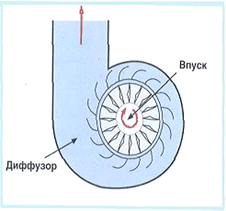
Рис.1.
Вращающиеся лопатки приводят к ускорению газа до высокой скорости, после чего скорость газа при расширении преобразуется в давление и соответственно уменьшается.
Идеальный газ. Законы, определяющие свойства и поведение газа, легче всего формулируются для случая так называемого идеального газа или газа относительно низкой плотности. В таком газе среднее расстояние между молекулами предполагается большим по сравнению с радиусом действия межмолекулярных сил. Порядок величины этого среднего расстояния можно определить как , где – n число частиц в единице объема или числовая плотность газа. Если пользоваться приближенной моделью взаимодействия частиц газа, в которой молекулы представляются твердыми упругими шариками диаметром d, то условие идеальности газа записывается как nd3 <<1. Характерный размер молекул газа можно в среднем оценить как d = 3·10–8 см. Это означает, что газ является идеальным, если n << 3·1022 см–3. Такому условию заведомо отвечает любой газ (например, воздух), находящийся при нормальных условиях (давление p = 1атм, температура T = 273K), поскольку при этих условиях число молекул в одном кубическом сантиметре газа равно 2,69·1019см–3 (число Лошмидта). При фиксированном давлении газа условие идеальности удовлетворяется тем лучше, чем выше температура газа, поскольку плотность газа, как это следует из уравнения состояния идеального газа в этом случае обратно пропорциональна его температуре.
Законы идеального газа были в свое время открыты опытным путем. Так еще в 17 в. был установлен закон Бойля – Мариотта
pV = const,
из которого следует, что изменение объема газа V при постоянной температуре T сопровождается таким изменением его давления p, что их произведение остается постоянной величиной.
Если газ находится в условиях, когда постоянным сохраняется его давление, но меняется температура (такие условия можно осуществить, например, поместив газ в сосуд, закрытый подвижным поршнем), то выполняется закон Гей-Люссака
V/T=const,
т.е. при фиксированном давлении отношение объема газа к его температуре является постоянным. Оба указанных закона объединяются в универсальное уравнение Клапейрона – Менделеева, которое называется также уравнением состояния идеального газа
pV = nRT.
Здесь n – число молей газа, R = 8,317 Дж/моль·K – универсальная газовая постоянная. Молем любого вещества называется такое его количество, масса которого в граммах равна атомной или молекулярной массе вещества М. В свою очередь, молекулярной массой вещества называется отношение массы молекулы этого вещества к так называемой атомной единице массы (а.е.м.), в качестве которой принимается масса равная 1/12 массы атома 12С (изотопа углерода с массовым числом 12). При этом 1 а.е.м. = 1,66·10–27 кг.
Один моль любого вещества содержит одно и то же число молекул, равное числу Авогадро моль–1. Число молей данного количества вещества определяется отношением массы вещества m к его молекулярной массе, т.е. n = m/M .
Используя соотношение n = N/V = nNA /V, уравнение состояния можно представить в виде, связывающем между собой давление, плотность и температуру
p = nkT,
где вводится величина k = R/NA = 1,38·10–23 Дж/K , которая носит название постоянной Больцмана.
Сжимаемость характеризуют относительной плотностью d = r/r0, где r0 — плотность при 0°С и р = 1 атм.
Сжатие может происходить как при постоянной температуре (изотермически), так и с одновременным разогревом сжимаемого тела (например, в адиабатном процессе). В последнем случае значения К будут большими, чем при изотермическом сжатии.
Для оценки сжимаемости веществ в широком диапазоне давлений используют уравнения состояния, выражающие связь между р, V и Т. Определяют сжимаемость непосредственно по изменению объёма тел под давлением, из акустических измерений скорости распространения упругих волн в веществе, из экспериментов по ударному сжатию, дающих зависимость между r и р при максимальных полученных в эксперименте давлениях.
Сжимаемость газов, будучи очень большой при давлениях до 1 кбар, по мере приближения их плотности к плотности жидкостей становится близкой к сжимаемости жидкостей.
Литература
 1. Черкасский В. М. Насосы, вентиляторы, компрессоры.-M.: Энергоатомиздат, 1984.
1. Черкасский В. М. Насосы, вентиляторы, компрессоры.-M.: Энергоатомиздат, 1984.



![]() 1. Черкасский В. М. Насосы, вентиляторы, компрессоры.-M.: Энергоатомиздат, 1984.
1. Черкасский В. М. Насосы, вентиляторы, компрессоры.-M.: Энергоатомиздат, 1984.